
 A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出). ,F为CO2,为直线形分子,反应①的化学方程式为2C+SiO2
,F为CO2,为直线形分子,反应①的化学方程式为2C+SiO2
| ||
 ;直线形;2C+SiO2
;直线形;2C+SiO2
| ||
| ||
| 9.6g |
| 64g/mol |
| ||
| ||
| ||
 ,
, .
.


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac查看答案和解析>>
科目:高中化学 来源: 题型:

| Ksp[Mg(OH)2] | Ksp[Fe(OH)3] | 氨气的饱和溶液 |
| 1.8×10-11 | 4.0×10-38 | c(OH-)=1×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
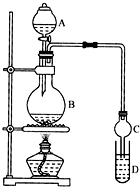 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
| 浓H2SO4 |
| 140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H-H | O═O | H-O | |
| 键能(kJ/mol) | 436.4 | a | 462.8 |
| A、185.2 |
| B、224.0 |
| C、518.8 |
| D、494.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com