

| ||
| 2 |
| ||
| 2 |
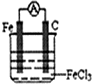 ,
, ;
;| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、物理溶解 | B、加成反应 |
| C、取代反应 | D、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153°C)与氢氧化铁制得.其结构如图.
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153°C)与氢氧化铁制得.其结构如图.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位.
如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位.查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com