
 如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位.
如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位.| m |
| V |
| 1 |
| 8 |
| 1 |
| 4 |
| m |
| V |
| ||
| (d×10-7)3 |
| (a+b+3c)×1021 |
| d3NA |
| (a+b+3c)×1021 |
| d3NA |


科目:高中化学 来源: 题型:
A、 该图表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
B、 该图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数 |
C、 图表示10mL0.01mol?L-1KMnO4酸性溶液与过量的0.1mol?L-1草酸溶液混合 |
D、 图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH2(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
| 浓H2SO4 |
| 140℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac查看答案和解析>>
科目:高中化学 来源: 题型:

| Ksp[Mg(OH)2] | Ksp[Fe(OH)3] | 氨气的饱和溶液 |
| 1.8×10-11 | 4.0×10-38 | c(OH-)=1×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4+Cl2→CH3Cl+HCl 取代反应 | ||
B、CH2=CH2+HCl
| ||
C、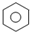 +Br2 +Br2
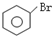 +HBr 取代反应 +HBr 取代反应 | ||
D、2CH3CH2OH+O2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com