
| A. | 向0.1mol•L-1的氨水中加入同体积的水 | |
| B. | 向0.1mol•L-1的KOH溶液中加入同体积的水 | |
| C. | 向0.2mol•L-1的氨水中加入同体积的0.1mol•L-1盐酸 | |
| D. | 向0.2mol•L-1的KOH溶液中加入同体积的0.1mol•L-1盐酸 |
分析 向0.1mol•L-1的氨水中加入同体积的水,近似于0.05mol•L-1的氨水,
向0.1mol•L-1的KOH溶液中加入同体积的水,近似于0.05mol•L-1的KOH溶液,
向0.2mol•L-1的氨水中加入同体积的0.1mol•L-1盐酸,近似于0.05mol•L-1的氨水和0.05mol•L-1的氯化铵溶液促成的混合物溶液,
向0.2mol•L-1的KOH溶液中加入同体积的0.1mol•L-1盐酸,近似于0.05mol•L-1的KOH溶液和0.05mol•L-1的氯化钠溶液组成的混合溶液,
氢氧化钠是强碱、氨水是弱碱,氯化铵对于一水合氨电离起抑制作用.
解答 解:向0.1mol•L-1的氨水中加入同体积的水,近似于0.05mol•L-1的氨水,
向0.1mol•L-1的KOH溶液中加入同体积的水,近似于0.05mol•L-1的KOH溶液,
向0.2mol•L-1的氨水中加入同体积的0.1mol•L-1盐酸,近似于0.05mol•L-1的氨水和0.05mol•L-1的氯化铵溶液促成的混合物溶液,
向0.2mol•L-1的KOH溶液中加入同体积的0.1mol•L-1盐酸,近似于0.05mol•L-1的KOH溶液和0.05mol•L-1的氯化钠溶液组成的混合溶液,
氢氧化钠是强碱、氨水是弱碱,氯化铵对于一水合氨电离起抑制作用,因此c(OH-)的浓度大小为B=D>A>C,
故选C.
点评 本题考查了溶液中离子浓度的大小比较,熟知强弱电解质的电离特点和电离平衡的影响因素是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
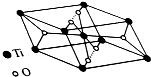 (1)下列说法正确的是AD(填序号)
(1)下列说法正确的是AD(填序号) ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA.
,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{c({H}^{+})}{c(OH)}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
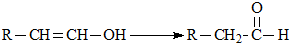 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系
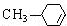 ,H:CH3COOCH=CH2
,H:CH3COOCH=CH2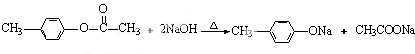
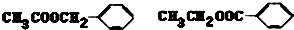 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相同的粒子一定属于同一种元素 | |
| B. | 同位素的性质几乎完全相同 | |
| C. | 质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 | |
| D. | 某种元素的相对原子质量取整数,就是其质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ①④⑤⑦ | C. | ②③④⑥ | D. | ④⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com