
| A. | Ag+→Ag | B. | CuO→Cu2+ | C. | SO2→SO3 | D. | CO→CO2 |
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
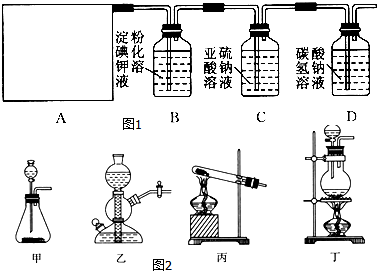
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: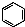 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$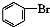 +HBr +HBr | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH$\stackrel{△}{→}$CH2=CH2+NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
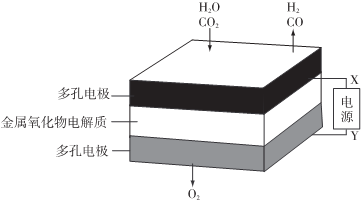
| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
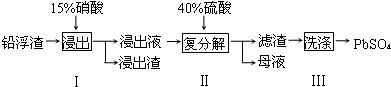
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1的氨水中加入同体积的水 | |
| B. | 向0.1mol•L-1的KOH溶液中加入同体积的水 | |
| C. | 向0.2mol•L-1的氨水中加入同体积的0.1mol•L-1盐酸 | |
| D. | 向0.2mol•L-1的KOH溶液中加入同体积的0.1mol•L-1盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其分子结构呈三角形 | B. | 分子中不存在孤对电子 | ||
| C. | 它的沸点比三氯化磷沸点低 | D. | 三氯化氮水解有硝酸生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2既被氧化又被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com