
分析 (1)当将反应物混合时,可观察到反应体系中绿色晶体逐步转变为棕黄色沉淀,说明反应物中有Cu(IO3)2、生成物中含有CuI,反应前如果向反应体系中滴加淀粉溶液无明显变化,反应后则得到蓝色溶液,说明生成物中含有碘,则反应物中含有KI,碘化钾的还原性在酸性条件下发生反应,所以反应物中还有硫酸,则生成物中含有水;
(2)失电子化合价升高的反应物是还原剂,得电子化合价降低的反应物是氧化剂,根据元素化合价变化确定硫酸的性质;
(3)根据方程式中 Cu(IO3)2和转移电子之间的关系式计算;
(4)由酸根离子和金属阳离子或铵根离子构成的化合物是盐,在水溶液里或熔融状态下能导电的化合物是电解质.
解答 解:(1)当将反应物混合时,可观察到反应体系中绿色晶体逐步转变为棕黄色沉淀,说明反应物中有Cu(IO3)2、生成物中含有CuI,反应前如果向反应体系中滴加淀粉溶液无明显变化,反应后则得到蓝色溶液,说明生成物中含有碘,则反应物中含有KI,碘化钾的还原性在酸性条件下发生反应,所以反应物中还有硫酸,则生成物中含有水,该反应中Cu元素化合价由+2价变为+1价、I元素化合价由-1、+5价变为0价,再结合原子守恒配平方程式得2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,
故答案为:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O;
(2)该反应中,Cu元素化合价由+2价变为+1价、I元素化合价由-1价、+5价变为0价,所以被氧化的元素是Cu、I,还原剂是KI,硫酸中各元素化合价不变,所以硫酸体现酸性,故答案为:Cu、I;KI;酸性;
(3)当有1mol Cu(IO3)2参加反应时,反应中转移电子的物质的量=11mol×(1-0)=11mol,
故答案为:11;
(4)该反应中属于盐类的有:Cu(IO3)2、KI、CuI、K2SO4,所以共有4种,电解质的有Cu(IO3)2、KI、H2SO4、CuI、K2SO4、H2O,所以共有6种,故答案为:4;6.
点评 本题考查了氧化还原反应及盐类和电解质的判断,根据反应现象确定反应物、生成物,再结合元素化合价变化确定氧化剂、还原剂,注意方程式的配平,难度较大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
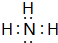 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 丁达尔现象可以用来区别胶体和溶液 | |
| C. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑧ | D. | ①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中的还原剂是C、氧化剂是S和KNO3 | |
| B. | 能做炸药的原因之一是固体物质反应生成了大量的气体 | |
| C. | 由此反应可推出S的氧化性强于N2 | |
| D. | 当生成标准状况下4.48L气体时,共转移电子0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁有剩余 | |
| B. | 往溶液中滴入无色KSCN溶液,显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物与还原产物的物质的量之比为2:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com