
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 丁达尔现象可以用来区别胶体和溶液 | |
| C. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
分析 A.胶体区别于其它分散系的本质是胶体分散质微粒直径的大小;
B.胶体具有丁达尔现象,而溶液不具有;
C.把饱和FeCl3溶液滴入沸水中加热到呈红褐色液体可制得Fe(OH)3胶体;
D.溶液和胶体的分散质粒子直径较小,均可以通过滤纸.
解答 解:A.胶体区别于其它分散系的本质是胶体分散质微粒直径的大小,分散质粒子直径在1nm~100nm之间的分散系属于胶体,故A正确;
B.胶体具有丁达尔现象,而溶液不具有丁达尔效应,因此丁达尔现象可以用来区别胶体和溶液,故B正确;
C.把饱和FeCl3溶液滴入沸水中加热到呈红褐色液体可制得Fe(OH)3胶体,故C错误;
D.溶液和胶体的分散质粒子直径较小,均可以通过滤纸孔隙,故D正确;
故选C.
点评 本题考查了胶体的性质,题目难度不大,注意掌握胶体和溶液的本质区别和鉴别的方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果容器内压强不再改变,则证明该反应已达到平衡状态 | |
| B. | 寻找合适的催化剂是加快反应速率并提高CO2产率的有效措施 | |
| C. | 当反应达到平衡后,保持容器内体积不变,再向其中充入CO和H2O(g)各1 mol,达到新的平衡后CO2的产率会增大 | |
| D. | 如果在某温度下平衡常数为9.0,则平衡时CO转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
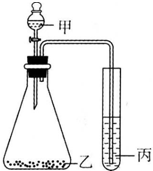
| A. | 甲-盐酸,乙-石灰石,丙-硅酸钠溶液,证明酸性:盐酸>H2CO3>H2SiO3 | |
| B. | 甲-盐酸,乙-亚硫酸钠,丙-溴水,证明还原性:HCI>SO2>HBr | |
| C. | 甲-浓盐酸,乙-高锰酸钾,丙-溴化钾,证明氧化性:KMnO4>Cl2>Br2 | |
| D. | 甲-氯化铵饱和溶液,乙-烧碱,丙-氯化铝,证明碱性:NaOH>NH3•H2O>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
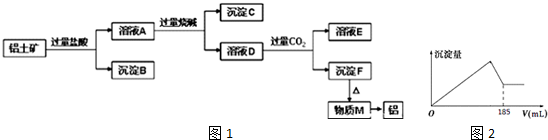
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
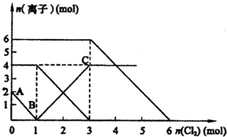 已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )| A. | 还原性:Fe2+>I->Br- | |
| B. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:2:3 | |
| C. | 原混合溶液中FeBr2的物质的量为6 mol | |
| D. | 当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “钴酞菁”分子既不能透过滤纸,又不能透过半透膜,混有氯化钠的“钴酞菁”可用渗析的方法净化 | |
| B. | “钴酞菁”与水所形成的分散系具有丁达尔效应 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(3)(4) | C. | (2)(4) | D. | (1)(4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com