
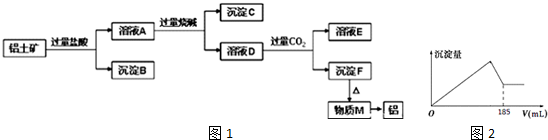
分析 Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,MgO、Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应;加入过量盐酸,溶液A为AlCl3、MgCl2、FeCl3,沉淀B为SiO2,加入过量烧碱,沉淀C为Fe(OH)3和Mg(OH)2,溶液D为NaAlO2,通入过量二氧化碳,溶液E为NaHCO3,沉淀F为Al(OH)3,加热分解得到M为Al2O3,经电解可得到Al,结合题目要求可解答该题.
解答 解:Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,MgO、Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应;加入过量盐酸,溶液A为AlCl3、MgCl2、FeCl3,沉淀B为SiO2,加入过量烧碱,沉淀C为Fe(OH)3和Mg(OH)2,溶液D为NaAlO2,通入过量二氧化碳,溶液E为NaHCO3,沉淀F为Al(OH)3,加热分解得到M为Al2O3,经电解可得到Al,
(1)流程甲加入盐酸后生成Al3+的离子方程式为Al2O3+6H+═2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
(2)B为二氧化硅,与氢氧化钠反应生成硅酸钠,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)D含有NaAlO2,通入过量二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)因氢氧化铝溶于盐酸,不能用盐酸代替二氧化碳,故答案为:不能;Al(OH)3 沉淀会溶于过量的盐酸中;
(5)E为NaHCO3,可 制纯碱或做发酵粉等,故答案为:NaHCO3; 制纯碱或做发酵粉等;
(6)由图象可知氢氧化铝完全沉淀时消耗185mL氢氧化钠,即消耗0.185molNaOH,设含有xmolAl3+,ymolFe3+,
涉及离子方程式为Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,
$\left\{\begin{array}{l}{x+y=0.05}\\{4x+3y=0.185}\end{array}\right.$
x=0.035,
故答案为:0.035.
点评 本题以推断题的形式,考查金属及其化合物的相关性质.对此类题型的考查通常用结合铝及其化合物.解题的关键在于熟练掌握“铝三角”的相关反应,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压32g O2 含2NA个原子 | |
| B. | 标准状况下11.2L H2O 含有的原子数目为1.5NA | |
| C. | 1mol的Cl- 含有NA个电子 | |
| D. | 0.5mol/L的NaCl 溶液中Cl-的个数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | NH3 | C. | CO2 | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
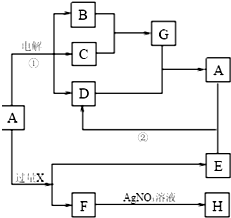 已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行):
已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行): .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 丁达尔现象可以用来区别胶体和溶液 | |
| C. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com