
【题目】有机物Z常用于治疗心律失常,Z可由有机物X和Y在一定条件下反应制得,下列叙述正确的是
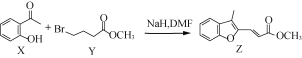
A.X中所有原子可能在同一平面内
B.X、Z均能与酸性KMnO4溶液反应
C.1 mol Y最多能与2 mol NaOH反应
D.室温下Z与足量Br2加成产物的分子中有2个手性碳原子
科目:高中化学 来源: 题型:
【题目】氯化锌(ZnCl2)可用作有机合成脱水剂、催化剂、缩合剂等。某实验小组在实验室采用HCl气体“置换”除水与ZnCl2升华相结合的方法从市售的氯化锌[含Zn(OH)Cl]制备高纯度无水氯化锌,装置如图所示。
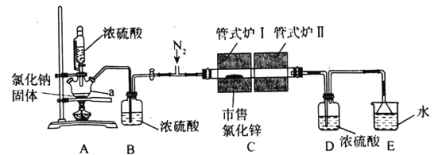
实验步骤:
①仪器连接完毕后,打开恒压滴液漏斗活塞,同时通入干燥纯净的N2。
②对管式炉I、管式炉II进行加热,管式炉I加热至150℃时开始反应,保持一段时间至置换除水完全再升温,继续升温约至550℃时不再有水蒸气蒸出。
③对管式炉I继续升温至770~800℃之间,至ZnCl2全部升华至管式炉II,停止加热管式炉I,并关闭恒压滴液漏斗活塞。
④继续通N2至尾气不再显酸性为止,在N2保护下将升华ZnCl2粉末分装在已知重量一端封闭的玻璃管中,用焊枪封口,称重,备用。
请回答下列问题:
(1)仪器a的名称为___,恒压滴液漏斗的作用为___。
(2)HCl气体“置换”除水的化学反应方程式为___。
(3)步骤②对管式炉II进行加热的目的为___。
(4)步骤②、③仍一直通入N2的目的分别为___、___。
(5)如无装置D,则会导致的后果为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法转化CO2实现CO2资源化利用。电解CO2制甲酸盐的装置如图所示。下列说法中正确的是( )
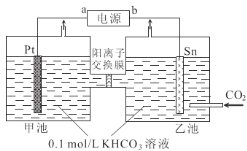
A.b是电源正极
B.K+由乙池向甲池迁移
C.甲池中KHCO3溶液浓度增大,乙池中KHCO3溶液浓度降低
D.乙池电极反应式为:CO2+HCO3-+2e-=HCOO-+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如下图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B.C两元素的核电荷数之和是A元素原子序数的4倍。下列说法正确的是
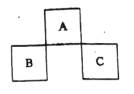
A.C位于元素周期表中第3周期第VA族
B.B的非金属性比A强
C.C的气态氢化物的稳定性比B的强
D.原子半径:r(B)<r(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.MgO(s)+C(s)=CO(g)+Mg(g)高温下能自发进行,则该反应ΔH>0、ΔS>0
B.常温下等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C.0.1 mol·L-1 NH4Cl溶液加水稀释,![]() 的值增大
的值增大
D.对于反应2SO2+O22SO3,使用催化剂能加快反应速率并提高SO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
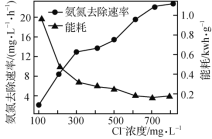
①写出电解时阳极的电极反应式:________________。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________。
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________。
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼铁混合精矿含有硼镁石[MgBO2(OH)、磁铁矿(Fe3O4)、磁黄铁矿(FexS)、品质铀矿(UO2)等,以该矿为原料制备MgSO4·H2O和硼酸(H3BO3)的工艺流程如下:
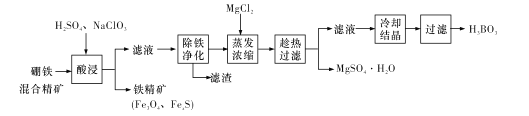
已知:![]() 在pH为4~5的溶液中生成UO2(OH)2沉淀。
在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(l)“酸浸”时,为了提高浸出率可采取的措施有:________ (至少答两个措施),该步骤中NaC1O3可将UO2转化为![]() ,则该反应的离子方程式为_____。
,则该反应的离子方程式为_____。
(2)“除铁净化”需要加入____(填化学式)把溶液pH调节至4~5,滤渣的成分是_______。
(3)“蒸发浓缩”时,加入固体MgC12的作用是 ___。
(4)铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
![]() ,
,![]() ,
,![]() 回答下列问题:
回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:![]() ,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
②在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的c(Fe2+)/c(Fe3+)会 __(填“变大”“变小”或“不变”),请结合相关数据推理说明:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.5molL-1氨水和KOH溶液分别滴入到体积均为20mL且浓度相同的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示,下列说法中错误的是( )
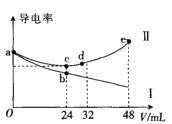
A.AlCl3溶液的物质的量浓度为0.2molL-1
B.根据图象可以确定导电率与离子种类有关
C.cd段发生的反应是Al(OH)3+OH-=AlO2-+2H2O
D.e点时溶液中的离子浓度:c(K+) =c(Cl-) +c(AlO2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用相同浓度的NaOH溶液,分别滴定20mL0.1mol·L-1的三种酸(HA、HB和HD)溶液体积的变化曲线如图所示。下列判断正确的是( )
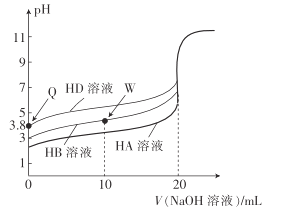
A.由Q点可知,HD的电离平衡常数Ka≈10-7.6
B.三种酸的酸性强弱:HD>HB>HA
C.滴定至W点时,溶液中存在:c(B-)>c(Na+)>c(H+)>c(OH-)
D.当三种溶液恰好完全中和后将其混合,溶液中存在:c(Na+)=c(A-)+c(B-)+c(D-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com