
【题目】硼铁混合精矿含有硼镁石[MgBO2(OH)、磁铁矿(Fe3O4)、磁黄铁矿(FexS)、品质铀矿(UO2)等,以该矿为原料制备MgSO4·H2O和硼酸(H3BO3)的工艺流程如下:
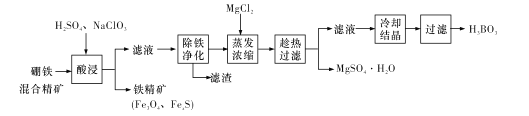
已知:![]() 在pH为4~5的溶液中生成UO2(OH)2沉淀。
在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(l)“酸浸”时,为了提高浸出率可采取的措施有:________ (至少答两个措施),该步骤中NaC1O3可将UO2转化为![]() ,则该反应的离子方程式为_____。
,则该反应的离子方程式为_____。
(2)“除铁净化”需要加入____(填化学式)把溶液pH调节至4~5,滤渣的成分是_______。
(3)“蒸发浓缩”时,加入固体MgC12的作用是 ___。
(4)铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
![]() ,
,![]() ,
,![]() 回答下列问题:
回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:![]() ,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
②在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的c(Fe2+)/c(Fe3+)会 __(填“变大”“变小”或“不变”),请结合相关数据推理说明:____。
【答案】搅拌、升高温度、延长浸出时间、适当提高硫酸的浓度,将硼铁矿粉碎等(任选两种) 3UO22++6H++ClO3-=UO22++3H2O+Cl- MgO或Mg(OH)2 Fe(OH)3、UO2(OH)2 增大镁离子浓度,有利于析出MgSO4H2O 2.5×10(37-3a) 变大 ![]() =
=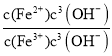 =
=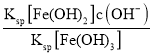 =
=![]() =2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则
=2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则![]() 变大
变大
【解析】
硼铁混合精矿含有硼镁石[MgBO2(OH)]、磁铁矿(Fe3O4)、磁黄铁矿(FexS)、晶质铀矿(UO2)等,加入硫酸、NaClO3,NaClO3可将UO2转化为UO22+,过滤除去少量铁精矿(Fe3O4、FexS),滤液调节pH除铁净化,可生成氢氧化铁、UO2(OH)2沉淀,过滤后的溶液中加入氯化镁,进行蒸发浓缩,趁热过滤可得到硫酸镁晶体,滤液中含有硼酸,冷却结晶得到硼酸(H3BO3)晶体,据此分析解答。
(1)酸浸”时,为了提高浸出率可采取的措施有:搅拌、升高温度、延长浸出时间、适当提高硫酸的浓度,将硼铁矿粉碎等;NaClO3可将UO2转化为UO22+,反应的离子方程式为3UO22++6H++ClO3-=UO22++3H2O+Cl-,故答案为:搅拌、升高温度、延长浸出时间、适当提高硫酸的浓度,将硼铁矿粉碎等; 3UO22++6H++ClO3-=UO22++3H2O+Cl-;
(2)除铁净化时,应调节pH,为避免引入新杂质,可加入MgO或Mg(OH)2等,生成沉淀为Fe(OH)3、UO2(OH)2,故答案为:MgO或Mg(OH)2;Fe(OH)3、UO2(OH)2;
(3)“蒸发浓缩”时,加入固体MgCl2,可使溶液中镁离子浓度增大,有利于析出MgSO4H2O,故答案为:增大镁离子浓度,有利于析出MgSO4H2O;
(4)①在T℃, Fe3+水解方程式为![]() ,则该条件下Fe3+水解反应的平衡常数K=
,则该条件下Fe3+水解反应的平衡常数K=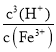 =
=![]() =
=![]() =2.5×10(37-3a),故答案为:2.5×10(37-3a);
=2.5×10(37-3a),故答案为:2.5×10(37-3a);
(4)铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
![]() 回答下列问题:
回答下列问题:
②![]() =
=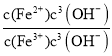 =
=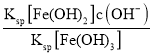 =
=![]() =2.0×1022×c(OH-),在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体,溶液中的c(OH-)增大,则
=2.0×1022×c(OH-),在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体,溶液中的c(OH-)增大,则![]() 变大,故答案为:变大;
变大,故答案为:变大;![]() =
=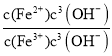 =
=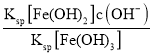 =
=![]() =2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则
=2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则![]() 变大。
变大。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾分类正在全国逐渐推广,垃圾资源化是可持续、绿色发展的重要途径。由金属废料(主要含铁、铜和它们的氧化物)制得碱式碳酸铜和摩尔盐[(NH4)2SO4·FeSO4·xH2O]的工艺流程如图所示:

已知:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=2.2×10-20,一般认为某离子浓度小于或等于10-5mol/L时,该离子转化或去除完全。
请回答下列问题:
(1)热纯碱的作用是__,H2O2的电子式为__。
(2)调pH步骤可选用的试剂为__。
A.CuO B.Cu(OH)2 C.Fe2O3 D.Fe(OH)3
(3)若所得溶液中c(Cu2+)=0.22mol·L-1,则需要调节的pH范围是__。
(4)溶液1经过加热、蒸发至__时,自然冷却即可得到晶体,然后抽滤,用酒精洗涤晶体,酒精洗涤的目的是__。
(5)写出该流程中生成碱式碳酸铜的离子方程式__。
(6)取3.92g摩尔盐产品,在隔绝空气的条件下加热至135°C时完全失去结晶水,此时固体质量为2.84g,则该摩尔盐结晶水个数x=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z常用于治疗心律失常,Z可由有机物X和Y在一定条件下反应制得,下列叙述正确的是
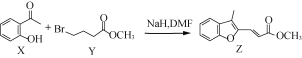
A.X中所有原子可能在同一平面内
B.X、Z均能与酸性KMnO4溶液反应
C.1 mol Y最多能与2 mol NaOH反应
D.室温下Z与足量Br2加成产物的分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是

A.水的电离程度:M>PB.图中P点至Q点对应溶液中 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
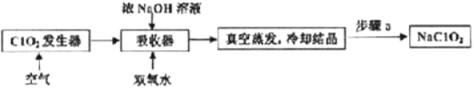
下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中,各分子的空间构型、中心原子的杂化方式以及孤电子对数均正确的是
选项 | 分子 | 空间构型 | 杂化方式 | 孤电子对数 |
A | NH3 | 平面三角形 | sp3杂化 | N含有一对孤电子对 |
B | CCl4 | 正四面体 | sp3杂化 | C不含有孤电子对 |
C | H2O | V形 | sp2杂化 | O含有两对孤电子对 |
D | CO32- | 三角锥形 | sp3杂化 | C含有一对孤电子对 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物F(![]() )是有机合成的中间体。现以甲苯为原料合成F的路线如图所示。
)是有机合成的中间体。现以甲苯为原料合成F的路线如图所示。

已知:①R-CN![]() R-COOH
R-COOH
②
回答下列问题:
(1)A→B的反应试剂是___。
(2)B→C反应的化学方程式为___,反应类型是___。D→E的反应类型是___。
(3)D中含氧官能团的名称是___。
(4)G是F的同系物,比F多一个碳原子,其苯环上含两个取代基的同分异构体有___种(不考虑立体异构)。其中核磁共振氢谱有六组峰,且峰面积之比为1:1:1:2:2:3的有机物结构简式为___。
(5)结合以上合成路线及相关信息,设计由苯合成苯酚的合成路线___。(用合成流程图表示,并注明反应条件)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com