
【题目】下列物质在光照条件下不能发生化学反应的是( )
A.硝酸银B.次氯酸C.氯化钠D.氢气和氯气混合气
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒的原子序数为34,是硫的同主族元素,硒的单质及其化合物用途非常广泛。
(1)硒位于周期表第______,周期___族。Se2Cl2常用作分析试剂,其电子式为_______。
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HC1O与Cu2Se的物质的量之比为____。用氨水中和亚硒酸后得到亚硒酸铵,再向( NH4)2SeO3溶液中加入Na2S2O3可得到纳米硒,同时生成亚硫酸盐,(NH4)2SeO3与Na2S2O3反应生成纳米硒的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家在青蒿素应用领城取得重大进展,如利用下述反应过程可以制取治疗疟疾的首选药青蒿琥酯。下列有关说法正确的是
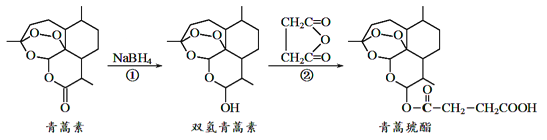
A. 青蒿素分子中所有碳原子在同一平面内
B. 反应①属于还原反应,反应②理论上原子利用率可达100%
C. 双氢青蒿素属于芳香族化合物
D. 青蒿琥酯可以发生水解、酯化以及加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A. 乙醇的结构简式:C2H6O
B. 氨基的电子式: ![]()
C. 镁离子的结构示意图:![]()
D. 制备Fe(OH)3胶体的离子方程式:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 ![]()
![]() 的NaOH溶液,下列情况会导致溶液浓度偏低的是( )
的NaOH溶液,下列情况会导致溶液浓度偏低的是( )
A. 容量瓶使用前经蒸馏水清洗后没有干燥
B. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C. 俯视确定凹液面与刻度线相切
D. 用敞口容器称量NaOH且时间过长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取重铭酸钾(K2Cr2O7)的流程如下:

已知:2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(1)上述氧化过程中,若将1 mol Cr2O3转化成Na2CrO4,消耗氧气的体积(标准状况)是__________。
(2)称取重铬酸钾试样2.40g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6 min左右,然后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-=2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00 mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,其中浓硫酸除了做吸水剂和脱水剂的作用外还有_________;
[装置设计]甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是__(选填“甲”或“乙”).丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是_________;
[实验步骤](1)按选择的装置组装仪器,在试管中先加入3mI乙醇,2m1冰醋酸,并在摇动下缓缓加入2mI浓硫酸充分摇匀,(2)将试管固定在铁架上;(3)在试管②中加入适量的饱和Na2CO3溶液;(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。

[问题讨论]a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:无色油状液体、____;
b.试管②中饱和Na2CO3的作用是溶解乙醇、降低乙酸乙酯的溶解度还有______的作用;
c.从试管②中分离出乙酸乙酯的实验操作是______;
d、生成乙酸乙酯的化学反应方程______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活生产中常见物质的化学式与名称相对应的是( )
A.FeSO4·7H2O —绿矾B.Na2O2—火碱
C.BaCO3 —重晶石D.C6H12O6 —蔗糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com