
[化学—选修化学与技术](15分)
工业上常用氨氧化法生产硝酸,其生产过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
⑴氨催化氧化反应在一定温度下(水为气体)为正反应放热的可逆反应,写出该反应的化学方程式 和平衡常数表达式K= ,若升高温度,则K的值 (填“增大”“减小”或“不变”)。
⑵为了提高NH3的转化率,可以采取 。
a.减小压强b.增大反应物浓度c.使用催化剂d.降低温度e.及时分离出NH3
⑶原料气中空气必须过量,其主要原因是 。
⑷将铂铑合金做成薄丝网的主要原因是 。
⑸水吸收二氧化氮生成硝酸为放热反应,其化学方程式为 ,
为了提高水对二氧化氮的吸收率,可采取的措施为 (答2项)。
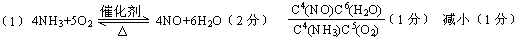 (2)abd(3)提高氨的转化率和一氧化氮的转化率(4)增大单位质量的催化剂与反应物的接触面积(5)3NO2+H2O=2HNO3+NO加压、降温
(2)abd(3)提高氨的转化率和一氧化氮的转化率(4)增大单位质量的催化剂与反应物的接触面积(5)3NO2+H2O=2HNO3+NO加压、降温
【解析】(1)在书写化学平衡常数的时候,注意水不要漏掉;(2)根据该反应的正反应是吸热反应,可以采用降低温度的方法,该反应的正反应是体积增大的反应,可以采用减小压强的方法,增大反应物的浓度,反应向正方向进行,故选abd;(3)空气过量,即增大了氧气的浓度,反应朝有利于NO生成的方向进行;(4)做成网状主要是增大单位质量的催化剂与反应物的接触面积;(5)方程式是3NO2+H2O=2HNO3+NO,提高水对二氧化氮的吸收率,就是提高NO2的转化率,可以采用加压、降温的方法。


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
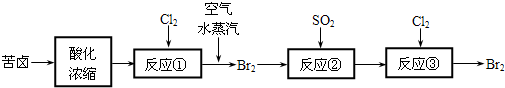
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
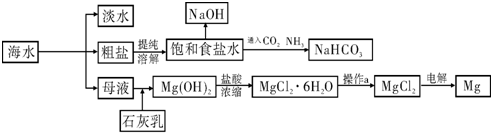
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com