
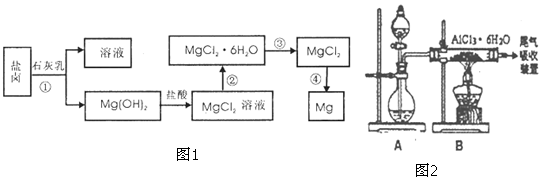
分析 向海水中加入沉淀剂石灰乳,镁离子转化为Mg(OH)2,采用过滤的方法分离溶液和Mg(OH)2,Mg(OH)2将溶于稀盐酸得到MgCl2溶液,将MgCl2溶液在HCl氛围中蒸干得到MgCl2固体,电解熔融MgCl2固体得Mg,
(1)除杂原理是不能引入新的杂质;分离不溶于水的固体的方法是过滤操作;
(2)电解无水氯化镁得到镁和氯气;
(3)①AlCl3的水解,直接加热AlCl3•6H2O,水解彻底生成氢氧化铝,得不到氯化铝,
②浓硫酸稀释放热,氯化氢具有挥发性,而浓硫酸难挥发;
③为使稀释放出更多的热量,便于氯化氢的挥发,控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中;
(4)明矾溶解后的铝离子和小苏打中的碳酸氢根离子在溶液中发生双水解生成氢氧化铝和二氧化碳.
解答 解:(1)Ca(OH)2能与饱和MgCl2溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀,在此过程中玻璃棒的作用是搅拌和引流,
故答案为:饱和MgCl2溶液;过滤、洗涤;引流;
(2)电解无水氯化镁得到镁和氯气,方程式为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(3)①AlCl3的水解,直接加热AlCl3•6H2O,水解彻底生成氢氧化铝,方程式为:AlCl3+3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑,得不到氯化铝,
故答案为:AlCl3+3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑;
②浓硫酸稀释放热,氯化氢具有挥发性,而浓硫酸难挥发,所以浓盐酸滴加到浓硫酸中有氯化氢气体产生,
故答案为:浓盐酸;
③为使稀释放出更多的热量,便于氯化氢的挥发,控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中,
故答案为:控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中.
(4)含有铝元素的另一物质明矾作为膨化剂炸油条(饼)或膨化食品时,若在面粉里加入小苏打后,再加入明矾,则会使等量的小苏打释放出比单放小苏打多一倍的二氧化碳,这样就可以使油条(饼)在热油锅中一下子就鼓起来,得到香脆可口的油条(饼)了.请用化学反应方程式解释得到香脆可口的油条(饼)的原因:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题主要考查了工业生产来提取镁的流程、实验基本操作、盐类水解等知识点,掌握原理是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
 ,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.
,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脱氢反应是放热反应 | |
| B. | 800℃下达到平衡时,苯乙烯的体积分数为40% | |
| C. | 900℃下达到平衡时,乙苯的转化率为50% | |
| D. | 1 000℃下达到平衡时,H2的浓度为0.075 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
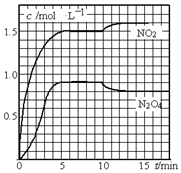 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体化学可用于制备纳米材料 | |
| B. | 钛合金主要用于尖端领域 | |
| C. | 压电陶瓷可实现化学能与电能的转化 | |
| D. | 稀土元素大大改善合金性能被称为冶金工业的维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
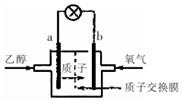 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:| A. | 电池工作时.质子向电池的负极迁移 | |
| B. | 电池工作时.电子由b极沿导线流向a极 | |
| C. | a极上发生的电极反应是:C2H5OH+3H2O+12e一=2CO2+12H+ | |
| D. | -b极上发生的电极反应是:4H++O2+4e一=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种. .
. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +
+ $→_{△}^{浓硫酸}$H2O+
$→_{△}^{浓硫酸}$H2O+
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com