
(18分)按要求回答下列问题
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用如图甲装置进行实验,试答下列问题:
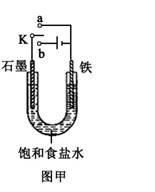
①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(3)已知:铅蓄电池总的化学方程式为:Pb+PbO2 +2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
①铅蓄电池在放电时负极反应为 ,
②铅蓄电池在充电时阳极反应为 ;
③如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4 mol。
(4)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):
c(OH-)-c(HA)= ___________ mol/L。
(5)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是 ,只能电离不能水解的离子是 ,既能电离又能水解的离子是 ,写出能水解离子的水解离子方程式 , 。
(6)已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,测得某溶液的pH = 13,则此温度下溶液中的c(Mg2+) = ____________________。
(1)②⑤(2分) (2)①吸氧(2分)
②2Cl-+2H2O H2↑+C12↑+2OH-(2分)
H2↑+C12↑+2OH-(2分)
(3)Pb+SO42--2e-=PbSO4(2分)PbSO4+2H2O-2e-=PbO2+SO42-+4H+(2分) 2(1分)
(4)10-8 (1分)(5)Al3+, (1分) HSO4-(1分) HS- (1分)
Al3+ +3 H2O Al(OH)3 +3H+
(1分) HS- + H2O
Al(OH)3 +3H+
(1分) HS- + H2O H2S + OH-(1分)
H2S + OH-(1分)
(6) 5.6×10-10mol·L-1(1分)
【解析】(1)①相当于稀释了氢氧化钠溶液的浓度,消耗氢氧化钠溶液的体积偏大,测定结果偏高。②也是相当于稀释了盐酸的浓度,消耗氢氧化钠溶液的体积偏小,测定结果偏低。③属于正确的操作,不影响结果。④相当于氢氧化钠溶液的体积偏大,测定结果偏高。滴定管的刻度线自上而下逐渐增大,所以俯视读数,读数偏小,则氢氧化钠溶液的体积偏小,测定结果偏低。
(2)开关K与a连接,是原电池装置,Fe发生电化学腐蚀。电解质溶液呈中性,故发生吸氧腐蚀。若K与b连接,则为石墨是阳极、Fe作阴极、电解饱和食盐水的装置。
①在原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应。根据总反应式可判断,Pb是负极,二氧化铅是正极。负极反应式为Pb+SO42--2e-=PbSO4。
②充电时,负极和负极相连,作阴极,正极和正极相连,作阳极。所以充电时阳极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+。
③根据总的反应式可知每消耗2mol硫酸,反应中就转移2mol电子。
(4)pH=8,溶液显碱性,说明酸是弱酸,A-水解显碱性。根据质子守恒可知c(OH-)=c(HA)+c(H+),所以c(OH-)-c(HA)=c(H+)=10-8mol/L。
(5)有弱才水解,无弱不水解,所以Al3+只能水解不能电离,HSO4-只能电离不能水解,HS-既能电离又能水解。
(6)根据溶度积常数的表达式Ksp = 可知
可知
c(Mg2+) =


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
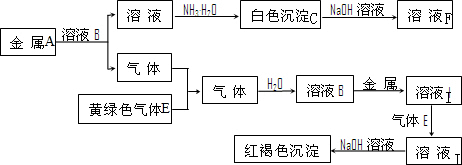
 A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH- H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com