
【题目】Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为________。
(2)配合物K4Fe(CN)6的中心离子的价电子排布图为______,该中心离子的配位数是_______。
(3)1mol HCN分子中含有σ键的数目为_______,HCN分子中碳原子轨道杂化类型是_______,与CN-互为等电子体的阴离子是_______。
(4)K2CO3中阴离子的空间构型为_________,其中碳原子的价层电子对数为____________。
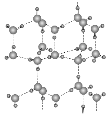
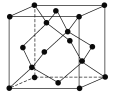
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞中有________个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为_______ (用NA表示阿伏加德罗常数的值)。
【答案】C<N<O ![]() 6 1.204×1024 sp杂化 C22- 平面三角形 3 16 ρ=
6 1.204×1024 sp杂化 C22- 平面三角形 3 16 ρ=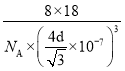
【解析】
(1)C、N、O三者为同周期元素,从左到右的顺序为C、N、O,非金属性C<N<O,则电负性的大小关系为C<N<O。答案为:C<N<O;
(2)配合物K4Fe(CN)6的中心离子为Fe2+,价电子排布式为3d6,则价电子排布图为![]() ,该中心离子的配体为CN-,配位数为6。答案为:
,该中心离子的配体为CN-,配位数为6。答案为:![]() ;6;
;6;
(3)2个原子间只能形成1个σ键,由此可确定1mol H-C≡N分子中含有σ键的数目为2×6.02×1023=1.204×1024,HCN分子中碳原子的价电子对数为2,则轨道杂化类型为sp杂化,与CN-互为等电子体的阴离子为C22-等。答案为:1.204×1024;sp杂化;C22-;
(4)K2CO3中阴离子为CO32-,中心碳原子形成1个碳氧双键和2个碳氧单键,阴离子的空间构型为平面三角形,其中碳原子的价层电子对数为3。答案为:平面三角形;3;
(5)冰的晶胞内部,共有4个水分子,每个水分子与周围水分子形成4个氢键,由此可确定在一个晶胞中氢键的数目为4×4=16;我们划定一个三角形如图![]() 中的二分之一,三个水分子分别位于顶点、面心和体内,则斜边为d nm,设晶胞的边长是anm,则两直角边分别为
中的二分之一,三个水分子分别位于顶点、面心和体内,则斜边为d nm,设晶胞的边长是anm,则两直角边分别为![]() a nm和
a nm和![]() a nm,则(
a nm,则(![]() a)2+(
a)2+(![]() a)2=d2,a=
a)2=d2,a=![]() nm,在1个晶胞中,共含有8个水分子,则ρ=
nm,在1个晶胞中,共含有8个水分子,则ρ=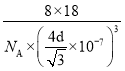 g·cm-3。答案为:16;ρ=
g·cm-3。答案为:16;ρ=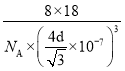 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物X是淀粉水解的最终产物;Y俗名酒精;Z是一种植物生长调节剂,可以把果实催熟,在催化剂作用下,Z可以制得重要的包装材料P。
请回答下列问题:
(1)X的分子式为___。
(2)Y与Na反应的化学方程式为___。
(3)Z→P反应的化学方程式为___,属___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是

A. 电池工作的过程中,d电极上产生气泡
B. 电池工作时,溶液中SO42-向d移动
C. c为负极,发生氧化反应
D. 电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基水杨酸钠(PAS-Na)是抑制结核杆茵最有效的药物。某同学设计的合成PAS-Na的两种路线如下:
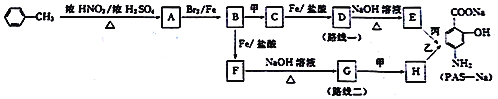
已知以下信息:
①甲、乙、丙为常用的无机试剂;
②![]()
③![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)甲和丙的名称分别是_________________、____________________。
(2)E的结构简式是______________________。
(3)A→B的化学方程式是______________________________________,反应类型是______。
(4)A的同分异构体中氨基(一NH2)与苯环直接相连并且能发生银镜反应的有____种,其中核磁共振氢谱为4组峰且面积之比为2:2:2:1的结构简式为___________。
(5)有同学认为“路线二”不合理,不能制备PAS-Na,你的观点及理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
(1)上述反应Ⅰ是原子经济性反应,写出化学反应方程式___________。
(2)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是_______(填一项即可)。
(3)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是_____。
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(4)生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:
化学键 | H—H | C—O | CO中的 C | H—O | C—H |
E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC![]() O所需的能量E1=______________kJ。
O所需的能量E1=______________kJ。
(5) H2还原CO2电化学法制备甲醇的工作原理如下图所示: ![]()
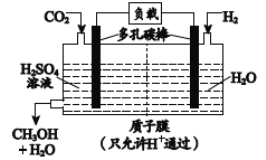
通入H2 的一端是电池的________极(填“正”或“负”),通入CO2的一端发生的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)工业合成氨是制取氮肥的基础。合成氨反应中,反应物 N2 的结构式是_______________,产物NH3 的电子式是_________________。
(2)某小组在实验室模拟以 NH3 为原料, 制备少量硝态氮肥 Ca(NO3)2,转化途径如下(转化所需试剂及条件已略去)。
![]()
①NO→NO2 的现象是______________, NO2→HNO3 的化学方程式为____________________。
②将HNO3 转化为 Ca(NO3)2,列举两种不同类别的化合物 M___________________(写化学式) 。
(3)①NH4HCO3 是一种铵态氮肥,需阴凉处保存,原因是_______________(写化学方程式)。
②实验室检验某化肥是铵态氮肥,检验过程中发生反应的离子方程式为___________________。
(4)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去) 
①X可能是SO3 或_______________,Y是_____________。
②尿素CO(NH2)2是一种常用有机氮肥,缓慢与 H2O 发生非氧化还原反应释放出NH3和另外一种气体,该反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验:

(1)先关闭活塞a,将6.4g铜片和10mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:打开活塞a之前______________;打开活塞a之后______________;
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整______________;
(2)实际上,在打开活塞a之前硫酸仍有剩余.为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量.他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________(填化学式);
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100mL溶液,再取20mL于锥形瓶中,用______________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为______________;再求出余酸的物质的量,若耗去amol/L氢氧化钠溶液bmL,则原余酸的物质的量为______________mol(用含a、b的表达式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E、F 六种短周期主族元素,其相关性质信息如下:
元素 | 相关信息 |
A | 地壳中含量最多的金属元素 |
B | 原子核外电子数和周期序数相等 |
C | 最外层电子数是次外层电子数的 3 倍 |
D | 最高正价与最低负价代数和为 4,常温下单质为固体 |
E | 在短周期元素中,原子半径最大 |
F | M 层比L 层少 1 个电子 |
请根据上述信息,完成下列问题:
(1)请给出元素 D 在元素周期表中的位置:________。
(2)请将 A、D、E、F 四种元素的简单离子按照离子半径由大到小排序(用离子符号表示):__________。
(3)请给出化合物 BFC 的电子式:______。
(4)用电子式表示 E 与 F 形成化合物 EF 的过程:______。
(5)请将 A、D、F 三种元素的最高价氧化物对应的水化物按照酸性由强到弱排序(用化学式表示):__________。
(6)元素 A 的单质常用于野外焊接钢轨,请写出该反应的化学方程式:________。
(7)单质 A 能溶于 E 的最高价氧化物对应水化物的水溶液,请给出该反应的离子方程式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com