
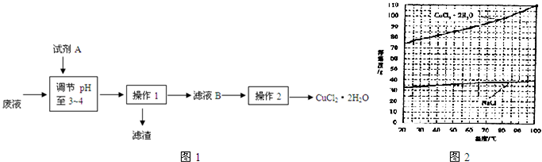
| 0.01mol×171g/mol |
| 2.0g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
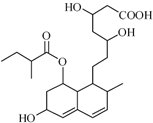 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A、能与FeCl3 溶液发生显色反应 |
| B、不能使酸性KMnO4 溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1 mol 该物质最多可与1 mol NaOH 反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
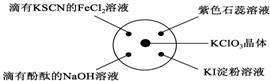 已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( ) | 选项 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
| B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
| C | 石蕊试液先变红后褪色 | Cl2具有漂白性 |
| D | KI淀粉溶液变蓝 | Cl2具有氧化性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有些放热反应发生时需要加热 |
| B、化学反应一定既有物质变化又有能量变化 |
| C、吸热反应都需要加热后才能发生 |
| D、化学反应热效应数值与反应物质多少有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y的离子具有相同的电子层结构 |
| B、X-比Y2-少一个电子层 |
| C、X+ 和Y2-具有相同的电子层结构 |
| D、X+比Y2-少一个电子层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com