


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、蒸馏时,温度计水银球应浸没在液体中 |
| B、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| C、蒸馏中,冷却水应从冷凝管的下口通入,上口流出 |
| D、把几滴FeCl3饱和溶液滴入250mL的沸水中制取Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2(g)+3H2(g)?2NH3 (g)△H=a kJ/mol |
| B、N2(g)+3H2(g)?2NH3 (g)△H=-a kJ/mol |
| C、N2(g)+3H2(g)?2NH3 (g)△H=5a kJ/mol |
| D、N2(g)+3H2(g)?2NH3(g)△H=-5a kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
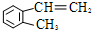 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.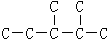 ,此烷烃的一溴代物有
,此烷烃的一溴代物有查看答案和解析>>
科目:高中化学 来源: 题型:
 醋酸是一种常见的弱酸.
醋酸是一种常见的弱酸.| 实验 编号 | 温度 (K) | 盐酸浓度 (mol?L-1) | 醋酸浓度 (mol?L-1) | 实验目的 |
| a | 298 | 0.20 |  | Ⅰ.实验a和b是探究 Ⅱ.实验a和c是探究 Ⅲ.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 |
| b | 308 | 0.20 |  | |
| c | 298 | 0.40 |  | |
| d |  |  |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B、0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D、常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
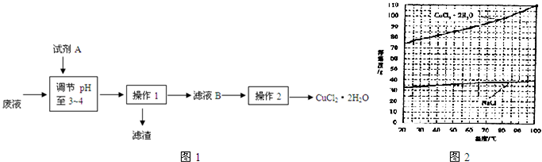
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com