
醋酸是一种常见的弱酸.
(1)假如某醋酸溶液中c(CH
3COOH)=0.10mol/L,c(H
+)=1.3×10
-3mol/L,则此时c(CH
3COO
-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程.[注:c
平衡(CH
3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol?L
-1与0.40mol?L
-1的HCl溶液、0.20mol?L
-1与0.40mol?L
-1的CH
3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
②若①中实验a镁条消失的时间是20s,则镁条剩余质量与时间关系图如下图.假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注.
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H
2O(g)═Mg(OH)
2(s)+H
2(g)△H
1=-441kJ?mol
-1②H
2O(g)═H
2(g)+
O
2(g)△H
2=+242kJ?mol
-1③Mg(s)+
O
2(g)═MgO(s)△H
3=-602kJ?mol
-1.
则氢氧化镁分解的热化学方程式是
.

 醋酸是一种常见的弱酸.
醋酸是一种常见的弱酸.




 ,故答案为:
,故答案为: ;
;

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案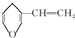 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种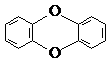 ,已知它的二氯代物有10种同分异构体,则其六氯代物的同分异构体也有10种
,已知它的二氯代物有10种同分异构体,则其六氯代物的同分异构体也有10种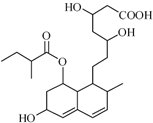 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )