
| A、(1)(2) |
| B、(3)(4) |
| C、(1)(3) |
| D、(2)(4) |


科目:高中化学 来源: 题型:
 醋酸是一种常见的弱酸.
醋酸是一种常见的弱酸.| 实验 编号 | 温度 (K) | 盐酸浓度 (mol?L-1) | 醋酸浓度 (mol?L-1) | 实验目的 |
| a | 298 | 0.20 |  | Ⅰ.实验a和b是探究 Ⅱ.实验a和c是探究 Ⅲ.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 |
| b | 308 | 0.20 |  | |
| c | 298 | 0.40 |  | |
| d |  |  |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
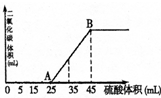 向100mL NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴加入1mol?L-1硫酸,所加入硫酸溶液体积与产生CO2体积关系如图所示:
向100mL NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴加入1mol?L-1硫酸,所加入硫酸溶液体积与产生CO2体积关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、248kJ/mol |
| B、496kJ/mol |
| C、862kJ/mol |
| D、431kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L |
| B、从1L2mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1mol/L |
| C、配制480mL0.5 mol/L的CuSO4溶液,需62.5g胆矾 |
| D、10g98%的硫酸(密度为1.84 g?cm-3)与10 mL18.4 mol?L-1的硫酸的浓度不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com