
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。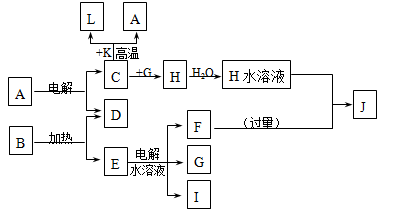
请回答:
(1)工业上制C用A不用H的原因
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)J与H反应的离子方程式为 。
(1)氯化铝是共价化合物,熔融状态下不导电
(2)2Al+Fe2O3 Al2O3+2Fe; 大于
Al2O3+2Fe; 大于
(3)2KCl+2H2O  2KOH+H2↑+Cl2↑
2KOH+H2↑+Cl2↑
(4)Al3++3AlO2-+6H2O 4Al(OH)3↓
4Al(OH)3↓
解析试题分析:C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色判断为Cl2;形成D的元素的原子最外层电子数是次外层的3倍推断为氧元素;B在焰色反应中呈紫色(透过蓝色钴玻璃)说明含有钾元素;K为红棕色粉末,判断为Fe2O3;L是常见金属,结合转化关系:C+K(Fe2O3)=L(Fe)+A;说明C为Al,A为Al2O3,H为AlCl3,转化关系E的水溶液电解得到F、G(Cl2)、I在G中燃烧判断I为H2,生成的产物为HCl,B加热生成D(O2)和E,判断E为KClO3,E为KCl,F为KOH;J为NaAlO2;
(1)工业上制C(Al)用A(Al2O3)不用H(AlCl3)的原因最根本的原因就是AlCl3是共价化合物,在熔融状态下以分子形式存在,而不能电离出离子,也就不能导电,也就无法进行电解了。
(2)C(Al)与K(Fe2O3)的反应是铝热反应。铝粉和某些金属氧化物(如氧化铁、氧化亚铁、四氧化三铁、五氧化二钒、三氧化二铬,二氧化锰等。注意:一定是某些金属氧化物,而不是所有的)组成的混合物称为铝热剂,它们之间的反应称为铝热反应。(铝热反应是利用铝的还原性,通过置换反应冶炼难溶的金属,如钒,锰,铁等)反应方程式:2AL+Fe2O3 2Fe+Al2O3。铝热反应是剧烈的放热反应,所以该反应的反应物总能量大于生成物总能量。
2Fe+Al2O3。铝热反应是剧烈的放热反应,所以该反应的反应物总能量大于生成物总能量。
(3)依据判断可知,L为Fe,用碳棒作阳极,L(Fe)作阴极不会参与反应,实质就是电解E(KCl)水溶液的化学方程式为:2KCl+2H2O 2KOH+H2↑+Cl2↑;
2KOH+H2↑+Cl2↑;
(4)J(NaAlO2)与H(AlCl3)反应发生双水解反应,反应的离子方程式为:Al3++3AlO2-+6H2O 4Al(OH)3↓ ;
4Al(OH)3↓ ;
考点:无机框图推断。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。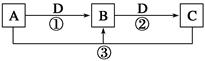
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是____________________;工业上制取A的离子方程式为______________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是____________________。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为____________________。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中学常见的某反应的化学方程式为A+B―→C+D+H2O(未配平,反应条件略去)。请回答下列有关问题:
(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。则A与B反应的离子方程式为 。
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为 。
(3)若该反应是实验室制取C气体的反应。已知C是黄绿色刺激性气味的气体,其水溶液呈酸性写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
置换反应的通式可表示为:
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)单质甲是生活中用途最广泛的金属,单质乙是最轻的气体,写出离子方程式: 。
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的化学方程式为 。
(3)若乙是一种红色金属单质,化合物B的溶液呈浅绿色,则该反应的离子方程式为 。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。
(5)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应的化学方程式 。
(6)若化合物B为黑色磁性晶体,,气体单质乙能在空气中燃烧,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: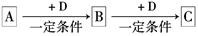
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为 。
(2)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明) 。
(3)若D是一种常见的温室气体,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,固体C受热分解可得固体B,该反应的化学方程式是 。
(4)若D为氯碱工业的主要产品,B具有两性,则B转化为C的离子方程式为 。
(5)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则元素D在周期表中的位
置是 ,B分子的结构式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。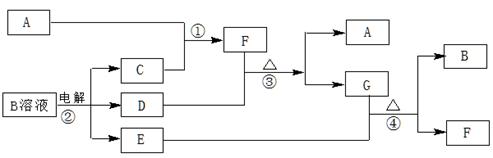
(1)写出化学式A ,D ,F ,G属于 晶体;
(2)鉴定G中阳离子的实验方法和现象__________________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式 、 。
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种物质都含有同种元素且有如图所示转化关系。试回答下列问题: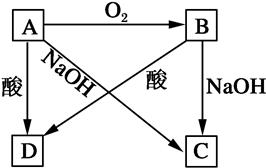
(1)若A是一种常见非金属,且是一种半导体材料。写出下列反应的方程式。
①B→D的化学方程式:__________________________________________________;
②A→C的离子方程式:__________________________________________________。
(2)若A是一种常见金属,此时酸为强酸。写出:A→D的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。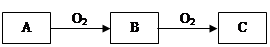
(1)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用 。
(2)若A是一种黄色单质固体,则B→C的化学方程式为 。
(3)若A是一种黑色单质固体,写出B的一个用途 。
(4)若C是红棕色气体,则A化学式可能为 ,试写出C与水反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中学化学中常见的几种物质存在下图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)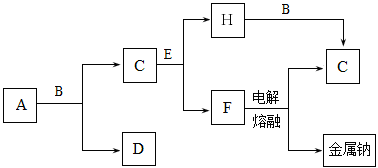
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式 。
(2)固体E中含有化学键的类型是 ,C与E反应的离子方程式为 。
(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为 。
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。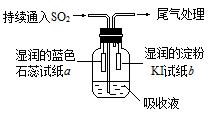
实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学的认为使a变红的是 (写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因 。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成
IO3-,从而使蓝色消失;二是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com