
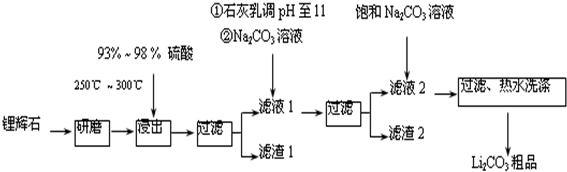
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
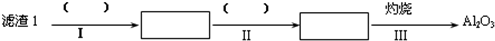
分析 根据Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓可知锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)经过研磨、加热、浓硫酸酸化得到可溶性的硫酸锂、少量硫酸钙、少量硫酸镁和不溶的Al2O3•4SiO2•H2O,经过过滤,得到滤渣1:Al2O3•4SiO2•H2O,向滤液1中加入石灰乳、碳酸钠,使Mg(OH)2、CaCO3更利于析出,以便形成滤渣2,过滤得到滤液2为硫酸锂溶液,向滤液2中加入饱合碳酸钠溶液,得到碳酸锂,热水洗涤Li2CO3,其溶解度随温度升高而减小,可减少Li2CO3的损失,得到最终产物碳酸锂,
(1)步骤Ⅱ中铝离子与氨水反应生成氢氧化铝沉淀;
(2)石灰乳是氢氧化钙,提供氢氧根离子和钙离子,更完全的沉淀镁离子和碳酸根离子;
(3)依据图表分析可知碳酸锂溶解度随温度升高减小;
(4)①Li2CO3溶于盐酸作电解槽的阳极液,阳极液中离子失电子,发生氧化反应,所以阳极反应为2C1--2e-=Cl2↑,阴极反应为2H++2e-=H2↑,离子选择透过膜只允许阳离子通过,电解过程中,Li+向阴极移动,而阴极电解后富余大量的OH-,阳极的Li+通过离子选择透过膜到阴极,这样阴极就得到比较纯净的LiOH;
②电解后向LiOH溶液中加入过量NH4HCO3溶液,氢氧化锂与碳酸氢铵反应生成碳酸锂.
解答 解:根据Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓可知锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)经过研磨、加热、浓硫酸酸化得到可溶性的硫酸锂、少量硫酸钙、少量硫酸镁和不溶的Al2O3•4SiO2•H2O,经过过滤,得到滤渣1:Al2O3•4SiO2•H2O,向滤液1中加入石灰乳、碳酸钠,使Mg(OH)2、CaCO3更利于析出,以便形成滤渣2,过滤得到滤液2为硫酸锂溶液,向滤液2中加入饱合碳酸钠溶液,得到碳酸锂,热水洗涤Li2CO3,其溶解度随温度升高而减小,可减少Li2CO3的损失,得到最终产物碳酸锂,
(1)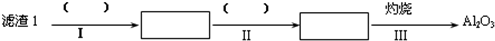 ,滤渣1是Al2O3•4SiO2•H2O,先加酸溶解,然后过滤出不溶物二氧化硅,步骤Ⅱ中在铝离子的酸溶液中滴入氨水,生成氢氧化铝沉淀,所以步骤Ⅱ反应是铝离子生成氢氧化铝的反应,反应离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
,滤渣1是Al2O3•4SiO2•H2O,先加酸溶解,然后过滤出不溶物二氧化硅,步骤Ⅱ中在铝离子的酸溶液中滴入氨水,生成氢氧化铝沉淀,所以步骤Ⅱ反应是铝离子生成氢氧化铝的反应,反应离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)石灰乳是氢氧化钙,提供氢氧根离子和钙离子,更完全的沉淀镁离子和碳酸根离子,
故答案为:增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出;
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”,图表中碳酸锂溶解度随温度升高减小,减少沉淀的损失,
故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(4)①Li2CO3溶于盐酸作电解槽的阳极液,阳极液中氯离子失电子,发生氧化反应,所以阳极反应为2C1--2e-=Cl2↑,
故答案为:2C1--2e-=Cl2↑;
②电解后向LiOH溶液中加入过量NH4HCO3溶液,氢氧化锂与碳酸氢铵反应生成碳酸锂的方程式为:2LiOH+NH4HCO3=Li2CO3+NH3+2H2O,
故答案为:2LiOH+NH4HCO3=Li2CO3+NH3+2H2O.
点评 本题考查了物质生产流程的分析判断,流程分析,物质性质的应用是解题关键,主要是铝及其化合物性质的应用,氧化铝的提取方法,题目难度中等.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学卷(解析版) 题型:选择题
下列关于反应热的说法正确的是
A.已知C(石墨,s)=C(金刚石,s) △H>0,说明金刚石比石墨稳定
B.已知H+(aq)+OH-(aq)=H2O(l) △H=-57.4kJ/mol,则含20.0gNaOH的稀溶液与稀醋酸完全中和,放出热量小于28.7kJ
C.已知甲烷的燃烧热为890.3kJ/mol,则表示甲烷燃烧热的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol
D.将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:填空题
(1)与16gO2所含原子总数相同的NH3标准状况下体积是 L;
(2)已知2LAl2(SO4)3溶液中c(Al3+)=3mol/L,则c(SO42-)= ,与3L mol/LNa2SO4中SO42-的物质的量浓度相等。
(3)同温同压下,同体积的NH3和H2S气体的质量比为 ;同质量的NH3和H2S气体的体积比为 ,其中含有的氢的原子个数比为 ;若二者氢原子数相等,它们的体积比为 。
(4)在标准状况下,8.96L的CH4和CO的混合气体,二者对氢气相对密度是9.5,混合气体平均摩尔质量为 ,混合气体中CH4的体积为 ,一氧化碳的质量分数为 ,二者原子个数比为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:选择题
在标准状况下①6.72LCH4 ②3.01×1023个HCl分子 ③13.6gH2S ④0.2molNH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>④>③>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abcd D.acd
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸或氢氟酸存放在配有磨口塞的棕色玻璃瓶中 | |
| B. | 汽油或煤油存放在带橡皮塞的棕色玻璃瓶中 | |
| C. | 用碱式滴定管准确量取25.00mL的KMnO4溶液 | |
| D. | 新制氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: | B. | NH3的电子式: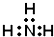 | ||
| C. | Ca2+的结构示意图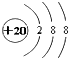 | D. | 次氯酸的结构式:H-Cl-O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com