
| A. | n-4 | B. | n+8 | C. | n-12 | D. | n+26 |
分析 A、除第-周期外的其它周期主族元素任意连续五种元素,都符合n-4;
B、因为过渡元素最少有10种元素,所以不可能n+8;
C、第四、五周期跨过渡元素的主族元素符合n-12;
D、第六、七周期跨过渡元素的主族元素符合n+26;
解答 解:A、除第-周期外的其它周期主族元素任意连续五种元素,都符合n-4,如铝与氯,故A不选;
B、因为过渡元素最少有10种元素,所以不可能n+8,故B选;
C、第四、五周期跨过渡元素的主族元素符合n-12,如32号的锗与20号钙,故C不选;
D、第六、七周期跨过渡元素的主族元素符合n+26,如55 铯和81的铊,故D不选;
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期中元素的种类数及同周期原子序数的关系为解答的关键,注意同主族元素不一定相邻,题目难度不大.


科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学卷(解析版) 题型:填空题
如下图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化。回答:
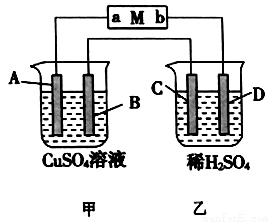
(1)甲、乙分别是什么装置?_____________、______________。
(2)写出A、B、C、D的电极名称以及电极材料和电极反应式。
A极:____________________;B极:______________________;
C极:______________________;D极:________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学b卷(解析版) 题型:选择题
下列实验操作中错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液蒸干
D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:选择题
下列实验操作正确的是
A. 当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好
B. 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管
C. 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液
D. 取用粉末状固体或固体小颗粒时,应用钥匙或纸槽,取用块状固体时,应用镊子夹取
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:选择题
2.16gX2O5中含有0.1molO,则X的相对原子质量为
A.21.6 B.28 C.14 D.31
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
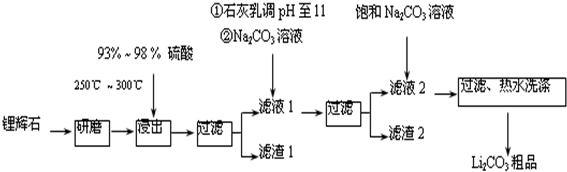
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
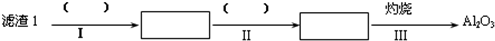
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
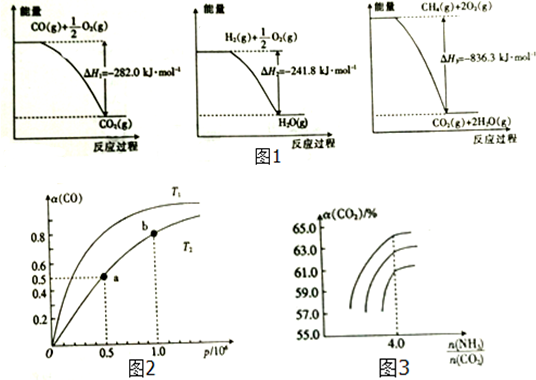
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸铵溶于水 | B. | 氢气在氯气中燃烧 | ||
| C. | 盐酸和氢氧化钠溶液反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、I2、HI的浓度相等 | |
| B. | 混合气体密度恒定不变 | |
| C. | 混合气体的质量不再改变 | |
| D. | 1个I-I键断裂的同时,有2个H-I键断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com