
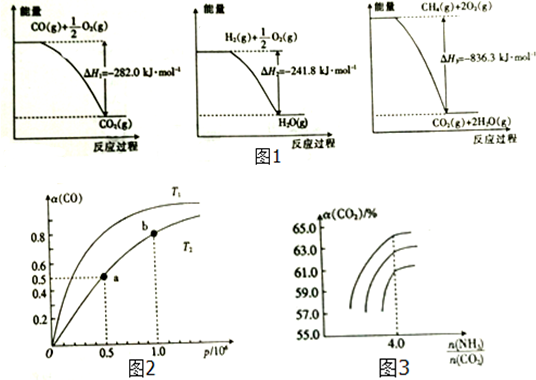
���� ��1������ͼ����д�Ȼ�ѧ����ʽ����ͼ�����ݿ�֪����CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-282.0 kJ•mol-1��
��H2��g��+$\frac{1}{2}$O2��g��=H2O��g����H=-241.8kJ•mol-1��
��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-836.3 kJ•mol-1��
��ϸ�˹���ɼ����-��-�ڡ�3�õ����Ȼ�ѧ����ʽ��
��2����ͼ�������֪a���b��ѹǿb����a����Ӧ������ѹǿ���������
����ͬѹǿ�£��¶�Խ��CO��ת�����ȴﵽ0.5��
����T1���¶��£�CO��g��+2H2��g��?CH3OH��g����H1��0����Ӧ�����������С�ķ��ȷ�Ӧ����Ӧ�ﵽƽ��״̬�ı�־�����淴Ӧ������ͬ������ֺ������ֲ��䣬���������ĸ���������������Ӧ�ﵽƽ��״̬����������ʼ�ж����ݣ�
��ͼ2��a��COת����Ϊ0.5�����ݻ�ѧƽ������ʽ��ʽ���㣬��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ���������
��3��$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$������4.0ʱCO2ת�����Ѿ��ܸߣ���ֵ����Զ�����̼ת����ԽС����
��� �⣺��1����ͼ�����ݿ�֪����CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-282.0 kJ•mol-1��
��H2��g��+$\frac{1}{2}$O2��g��=H2O��g����H=-241.8kJ•mol-1��
��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-836.3 kJ•mol-1��
��-��-�ڡ�3�õ���CH4��g��+H2O��g��=CO��g��+3H2��g����H=+171.1KJ/mol��
�ʴ�Ϊ��CH4��g��+H2O��g��=CO��g��+3H2��g����H=+171.1KJ/mol��
��2����ͼ�������֪a���b��ѹǿb����a����Ӧ������ѹǿ���������a��b����H2�ķ�Ӧ���ʣ�v��a����v��b����
�ʴ�Ϊ������
����ͬѹǿ�£��¶�Խ��CO��ת�����ȴﵽ0.5���÷�ӦΪ���ȷ�Ӧ��ͼ���֪T1��T2 �¶�Խ�߷�Ӧ����Խ�죬��T2�¶���COת���ʴﵽ0.5ʱ����ʱ����̣��ʴ�Ϊ��T2���÷�ӦΪ���ȷ�Ӧ��ͼ���֪T1��T2 �¶�Խ�߷�Ӧ����Խ�죬��T2�¶���COת���ʴﵽ0.5ʱ����ʱ����̣�
����һ�ݻ��ɱ���ܱ������У�1molCO��2molH2������Ӧ��CO��g��+2H2��g��?CH3OH��g����H1��0����T1���¶��£�CO��g��+2H2��g��?CH3OH��g����H1��0����Ӧ�����������С�ķ��ȷ�Ӧ��
a��H2������������CH3OH�������ʵ�2����ֻ��˵��������У�����˵���ﵽƽ��״̬����a���ϣ�
b��CH3OH������������ٸı��ǻ�ѧƽ��ı�־����b�����ϣ�
c����Ӧǰ�������������䣬��һ�ݻ��ɱ���ܱ������У����������ܶȲ��ٸı䣬��˵����Ӧ�ﵽƽ��״̬����c������
d����ѧ����ʽ��һ����̼�ͼ״����ʵ���֮����ͬ��CO��CH3OH�����ʵ���֮�ͱ��ֲ��䣬����˵����Ӧ�ﵽƽ��״̬����d���ϣ�
�ʴ�Ϊ��ad��
��ͼ2��a��COת����Ϊ0.5����ѹǿΪ0.5��106Pa�����ݻ�ѧƽ������ʽ��ʽ���㣬
CO��g��+2H2��g��?CH3OH��g��
��ʼ����mol�� 1 2 0
�仯����mol�� 0.5 1 0.5
ƽ������mol�� 0.5 1 0.5
��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ���������
ƽ�ⳣ��Kp=$\frac{P��C{H}_{3}OH��}{P��CO��{P}^{2}��{H}_{2}��}$�T$\frac{0.5��1{0}^{6}��\frac{0.5}{0.5+1+0.5}}{0.5��1{0}^{6}��\frac{0.5}{0.5+1+0.5}����0.5��1{0}^{6}��\frac{1}{0.5+1+0.5}��^{2}}$=1.6��10-11Pa-2��
�ʴ�Ϊ��1.6��10-11Pa-2��
��3��ͼ��仯������֪��$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$������4.0ʱCO2ת�����Ѿ��ܸߣ���$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$��4.0��CO2��ת��������������
�ʴ�Ϊ��$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$������4.0ʱCO2ת�����Ѿ��ܸߣ���$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$��4.0��CO2��ת��������������
���� ���⿼�����Ȼ�ѧ����ʽ��д����ѧ��Ӧ���ʺͻ�ѧƽ���Ӱ�����ط����жϡ�ƽ�ⳣ�������ͼ��仯����������Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶���10���¿���ѧ���������棩 ���ͣ�ѡ����
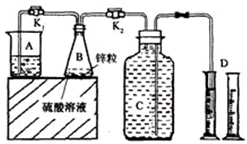
ʵ����������п����һ������ijŨ�ȵ����ᷴӦ����������Ϊ�����ռ�������������Ӧ���ʣ�ͬʱ�ֲ�Ӱ������H2�����������������м����������
A��K2SO4���� B��NaOH��Һ C������CuSO4��Һ D��CH3COONa����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ��һ��10���¿���ѧ���������棩 ���ͣ�ѡ����
����˵����ȷ����
A. ��ȡ����ʱ����������Ҫ������������ͨ����Һ©���ϿڵIJ��������е�
B. ���Բ�������Ũ������ȴ�ᾧ�ķ������������Һ�л������ؾ���
C. ���Ҵ���ˮ���룬��ͼ1��ͼ2����
D. ϡ��ŨH2SO4����ͼ3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | n-4 | B�� | n+8 | C�� | n-12 | D�� | n+26 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ȿ��ȼ��� | B�� | ���˼�ζ�� | ||
| C�� | �ӹ�ʳƷʱ���ӷ����� | D�� | ����ʱ�ӵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��
��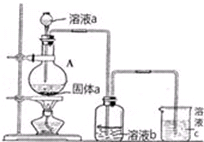
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | ����Ũ�� | ��������ͭ��Һ���/mL | B��Ӧ�ﵽƽ��ʱ��/min | ��1�����ռ��������/mL | ��2�����ռ��������/mL | ��3�����ռ��������/mL | �� |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | �� |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | �� |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | �� |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | aΪ��صĸ��� | |
| B�� | ��س��ʱa����ӦΪ��Li1-xMn2O4+xe-+xLi+�TLiMn2O4 | |
| C�� | ���ʱ��a��﮵Ļ��ϼ۷����仯 | |
| D�� | �ŵ�ʱ����Һ��SO42-��a��bǨ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �̲��ں��ġ���ȼ�����Ǹ�ѹ���γɵ��������ļ���ˮ������壮��������ѧ��֪ʶ�ش��������⣺
�̲��ں��ġ���ȼ�����Ǹ�ѹ���γɵ��������ļ���ˮ������壮��������ѧ��֪ʶ�ش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com