
工业生产纯械的工艺流程示意图如下
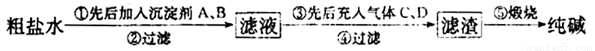
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式_________。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是_________(填化学式),原因是_________。
(3)通入C和D气体后发生反应的化学方程式是_________。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品________ (填写化学式),通氨气与加入细小食盐颗粒的作用是_________。
(5)写出⑤锻烧发生反应的化学方程式_________。产品纯碱中含有碳酸氢钠,若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质童分数ω(NaHCO3)= _________ (注明表达式中所用的有关符号的含义)。
(每空2分,第(1)问1分,共计15分)(1)Na2CO3
(2)NH3;因为在CO2水中的溶解度小,而NH3溶解度大
(3)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(4)NH4Cl;增大溶液中的Cl-、NH4+的浓度,降低NH4Cl的溶解度,使NH4Cl大量析出
(5)2NaHCO3 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;

【解析】
试题分析:(1)粗盐提纯时需要除去的杂质离子是Ca2+、Mg2+,A来源于石灰窑厂,则A是生石灰或熟石灰,用来除去Mg2+,而Ca2+一般用碳酸钠来除去,即B试剂是碳酸钠。
(2)由于在CO2水中的溶解度小,而NH3溶解度大,所以要先通入氨气,然后再通入CO2气体。
(3)由于碳酸氢钠的溶解度较小,所以向氨气饱和的氯化钠溶液中通入CO2气体会产生碳酸氢钠晶体,反应的化学方程式是NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
(4)由于溶液中含有氯离子和NH4+,所以加入细小食盐颗粒,增大溶液中的Cl-、NH4+的浓度,降低NH4Cl的溶解度,使NH4Cl大量析出,因此析出副产品是氯化铵。
(5)碳酸氢钠稳定性差,在加热的条件下能发生分解,反应的化学方程式为2NaHCO3 Na2CO3+CO2↑+H2O;假设加热前纯碱的质量为m(加热前),加热后的质量为m(加热后),则加热损失的质量为[m(加热前)-m(加热后)],因此根据方程式可知,纯碱中碳酸氢钠的质量为
Na2CO3+CO2↑+H2O;假设加热前纯碱的质量为m(加热前),加热后的质量为m(加热后),则加热损失的质量为[m(加热前)-m(加热后)],因此根据方程式可知,纯碱中碳酸氢钠的质量为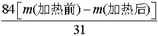 ,所以纯碱中含有的碳酸氢钠的质量分数为
,所以纯碱中含有的碳酸氢钠的质量分数为 。
。
考点:考查物质的分离与提纯、化学实验基本操作、实验条件的控制以及物质纯度的计算等


科目:高中化学 来源: 题型:
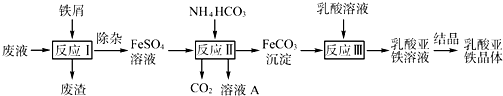
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. | 试管中仍有固体物质 | 固体为 |
| ②操作①后,过滤;在滤液中加入过量的 |
有红褐色沉淀产生 | 沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. | 生成物为Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
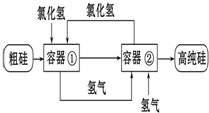 科学家最新研制的利用氯化氢和氢气生产高纯硅的工艺流程如图所示:容器①中进行的反应为Si(粗)+3HCl(g)═SiHCl3(l)+H2(g);容器②中进行的反应为SiHCl3+H2═Si(纯)+3HCl.下列说法中正确的是( )
科学家最新研制的利用氯化氢和氢气生产高纯硅的工艺流程如图所示:容器①中进行的反应为Si(粗)+3HCl(g)═SiHCl3(l)+H2(g);容器②中进行的反应为SiHCl3+H2═Si(纯)+3HCl.下列说法中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com