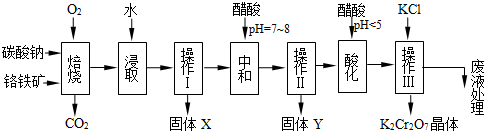
重铬酸钾(K
2Cr
2O
7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO?Cr
2O
3)为原料生产重铬酸钾.实验室模拟工业法用铬铁矿制K
2Cr
2O
7的主要工艺如图所示.反应器中涉及的主要反应是:
6FeO?Cr
2O
3+24NaOH+7KClO
312Na
2CrO
4+3Fe
2O
3+7KCl+12H
2O
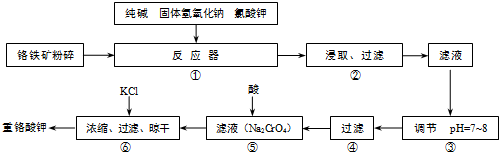
试回答下列问题:
(1)在反应器①中,有Na
2CrO
4生成,同时Fe
2O
3转变为NaFeO
2,杂质SiO
2、Al
2O
3与纯碱反应的原理相同均转变为可溶性盐.写出氧化铝与碳酸钠反应的化学方程式:
.
(2)操作⑤中加酸酸化后CrO
42-转化为Cr
2O
72-,写出转化的离子方程式:
.
(3)步骤③中测定pH值的操作为:
.
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
| 操作步骤 |
实验现象 |
结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. |
试管中仍有固体物质 |
固体为 |
| ②操作①后,过滤;在滤液中加入过量的 . |
有红褐色沉淀产生 |
沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. |
|
生成物为Al(OH)3 |
(5)称取重铬酸钾(其式量为294)试样2.5000g配成250mL溶液,用移液管取出25.00mL于碘量瓶中,加入10mL 2mol/L H
2SO
4和足量碘化钾(铬的还原产物为Cr
3+),放置于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/L Na
2S
2O
3标准溶液滴定(I
2+2S
2O
32-=2I
-+S
4O
62-).
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需
和
.
②若实验中共用去Na
2S
2O
3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)
.(保留2位小数)