(2010?德阳模拟)浓盐酸与重铬酸钾(K
2Cr
2O
7)共热时产生某种气体单质X和三氯化铬(CrCl
3)等,这种方法制取X时便于控制反应.实验室制得纯净、干燥的X装置如图I所示.
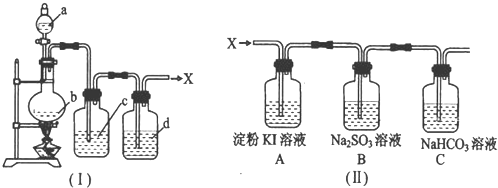
请回答下列问题:
(1)加热时,a与b反应的化学方程式是
K
2Cr
2O
7+14HCl
2CrCl
3+3Cl
2↑+2KCl+7H
2O
K
2Cr
2O
7+14HCl
2CrCl
3+3Cl
2↑+2KCl+7H
2O
.
(2)液体c的作用是
除去氯气中的氯化氢气体
除去氯气中的氯化氢气体
.
(3)现把制得的X持续通入图II所示的装置中进行性质实验.①A装置中可能出现的现象是
变蓝色
变蓝色
.②C装置中发生反应的离子方程式是
Cl2+HCO3-=Cl-+HClO+CO2↑
Cl2+HCO3-=Cl-+HClO+CO2↑
.
(4)向装有一定量的重铬酸钾(K
2Cr
2O
7)的圆底烧瓶中加入一定量的浓盐酸,为了提高浓盐酸的利用率可以采取的措施是
小火加热,并多次少量地向烧瓶中加入浓盐酸
小火加热,并多次少量地向烧瓶中加入浓盐酸
.
(5)若设计一个简单实验,证明B装置中的Na
2SO
3已被氧化,则实验操作及现象是
取反应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化
取反应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化
.




 名校课堂系列答案
名校课堂系列答案