
����Ŀ��C��N��S�������ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ����IJ���Ӱ�졣
��1���ڴ������ڵ������£���H2��NO��ԭΪN2����֪��

��������һ��������Ӧ���ɵ�����ˮ�������Ȼ�ѧ����ʽ��_____��
��2����500���ºϳɼ״��ķ�Ӧԭ��Ϊ��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)��1L���ܱ������У�����1mol CO2��3mol H2��ѹǿΪp0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ����ѹ�����ʵ�������)
CH3OH(g)��H2O(g)��1L���ܱ������У�����1mol CO2��3mol H2��ѹǿΪp0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ����ѹ�����ʵ�������)
�ٷ�Ӧ���е�4minʱ��v(��)__v(��) (����>����<����������)��0��4min��H2��ƽ����Ӧ����v(H2)��_mol��L��1��min��1��

��CO2ƽ��ʱ���������Ϊ___�����¶���KpΪ__(�ú���p0��ʽ�ӱ�ʾ)��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����___��
A.v��(CH3OH)��3v��(H2)
B.CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1
C.���º�ѹ�£������������ٱ仯
D.���º����£�������ܶȲ��ٱ仯
��500�桢��2���ݻ�����2L���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | ������ | ������ |
��Ӧ����ʼͶ���� | 1mol CO2��3mol H2 | 0.5mol CO2��1mol H2 1mol CH3OH��1mol H2O |
CH3OH��ƽ��Ũ��/mol ��L��1 | C1 | C2 |
���������з�Ӧ��ʼ��___������У�c1___c2��(����>����<����������)
��3���״���Ϊһ��ȼ�ϻ�������ȼ�ϵ�ء����¶�Ϊ650���������ȼ�ϵ�����ü״���������CO2�Ļ����������Ӧ������缫����Li2CO3��Na2CO3�����������ʡ��õ�صĸ�����ӦʽΪ___��
���𰸡�2NO(g)+2H2 (g)=N2(g)+2H2O(g) ��H=��734.7kJ��mol-1 > 0.375 10% 256/(3p02 )��![]() C �淴Ӧ < CH3OH��6e��+3CO32��=4CO2��+2H2O
C �淴Ӧ < CH3OH��6e��+3CO32��=4CO2��+2H2O
��������
��1����H=��Ӧ���ܼ���-�������ܼ��ܣ�
��2���ٸ���4min��Ӧ������������ı仯ȷ����Ӧ������v=��c/��t����״���CO2�����ʣ��ٸ������ʱȵ��ڻ�ѧ������֮�ȼ��� H2��
�ڸ�������ʽ�����㣻
�۱������ڷ����ı䣬֤����Ӧ�ﵽ��ƽ�⣻
��������ʽ�����жϣ�
��3��ȼ���ڸ�����Ӧ��������������Ӧ����д�缫��Ӧʽ��
��1����H=��Ӧ���ܼ���-�������ܼ���=2��630KJ/mol+2��436KJ/mol-941.7 KJ/mol-2��962.5KJ/mol=-734.7kJ��mol-1���Ȼ�ѧ����ʽΪ2NO(g)+2H2 (g)=N2(g)+2H2O(g) ��H=��734.7kJ��mol-1��
�𰸣�2NO(g)+2H2 (g)=N2(g)+2H2O(g) ��H=��734.7kJ��mol-1
��2���ٷ�Ӧ���е�4min�״���Ũ���������ӣ�������̼Ũ�����ڼ�С��˵����Ӧ��������У���v(��) >v(��)��0��4min��v��CO2��=![]() =0.125 mol��L��1��min��1����H2��ƽ����Ӧ����v(H2)=3 v��CO2����3��0.125=0.375mol��L��1��min��1��
=0.125 mol��L��1��min��1����H2��ƽ����Ӧ����v(H2)=3 v��CO2����3��0.125=0.375mol��L��1��min��1��
�𰸣�> 0.375
�� CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
n������ 1 3 0 0
��n 0.75 0.75 0.75 0.75
n��ƽ�⣩0.25 0.75 0.75 0.75
CO2ƽ��ʱ���������Ϊ![]() =10%��ƽ������ѹǿΪ
=10%��ƽ������ѹǿΪ![]() P0=
P0=![]() ��CO2������ѹǿΪ
��CO2������ѹǿΪ![]() =0.0625P0���������״���ˮ����ƽ�������ʵ�����ȣ�ѹǿ��ȣ�ѹǿ��Ϊ
=0.0625P0���������״���ˮ����ƽ�������ʵ�����ȣ�ѹǿ��ȣ�ѹǿ��Ϊ![]()
![]() =0.1875P0��ƽ�ⳣ��ΪKp=
=0.1875P0��ƽ�ⳣ��ΪKp=![]() =
= ![]() ��256/(3p02 )��
��256/(3p02 )��
�𰸣�10% 256/(3p02 )��![]()
��A.���ʱȲ����ڻ�ѧ������֮�ȣ���A����
B.��Ӧ��CO2��H2��H2O��CH3OH�����ʵ���Ũ��֮�Ⱦ����ڷ�Ӧ��ʼʱ�������ʵĶ��٣���ƽ��״̬�أ���B����
C.��Ϊ����ӦΪ���������С�ķ�Ӧ�����º�ѹʱ����Ӧ�����������������ڼ�С���������������ٱ仯����ﵽƽ��״̬����C��ȷ��
D.���������غ㶨�ɣ���Ӧǰ�������������䣬��������䣬���ܶ�ʼ�ղ��䣬�����ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬����D����
�𰸣�C
���ȸ��ݢڼ���K
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
c������ 1 3 0 0
��c 0.75 0.75 0.75 0.75
c��ƽ�⣩ 0.25 0.75 0.75 0.75
k==![]() =
=![]()
�����ң�
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
c������ 0.25 1/2 0.5 0.5
Qc=![]() =8>k,��Ӧ�淴Ӧ������С�
=8>k,��Ӧ�淴Ӧ������С�
�������������ʼ���ʵ���ȫ����Ϊ��Ӧ��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
n������ 0.5 1 1 1
�����n 1.5 4
�������з�Ӧ���Ũ�ȴ��������ף���ΪT��V��ͬ���������������ʵ�ƽ��Ũ�ȴ��ڼ����������ʵ�ƽ��Ũ�ȡ�
�𰸣��淴Ӧ <
��3���״�ȼ�ϵ���м״�ʧ���ӱ��������ڸ���������Ӧ���缫��ӦʽΪCH3OH+3CO32--6e-=4CO2+2H2O��
�𰸣� CH3OH+3CO32--6e-=4CO2+2H2O



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����Ϊ��������ȱ�������涨��ʳ���б�����������ĵ���ء�����ʳ�����Ƿ�ӵ⣬���������·�Ӧ��
KIO3+ KI+ H2SO4�T K2SO4+ I2 + H2O
��1����ƽ�÷���ʽ��������˫���ŷ���ʾ�÷���ʽ����ת�Ƶķ�������Ŀ��____________________
��2���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ______________��
��3�������Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W�ǵ�������Ԫ�أ���������������Ӧ��ˮ��������ˮ���õ�Ũ�Ⱦ�Ϊ0.010mol/L����Һ����pH��25�棩���ӦԪ��ԭ�Ӱ뾶�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A. �����ӵİ뾶��X>Z>W
B. ����̬�⻯����ȶ��ԣ�Z>W>Y
C. Y���ʿ����������뵼�����
D. n =2-lg2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ؽ���Ԫ�ظ��Ķ��Խϴ�����ˮ�辭������������ŷš�
��.ij��ҵ��ˮ����Ҫ����Cr3����ͬʱ������������Fe2����Fe3����Al3����Ca2����Mg2���ȣ������Խ�ǿ��Ϊ�������ã�ͨ�������������̴�����
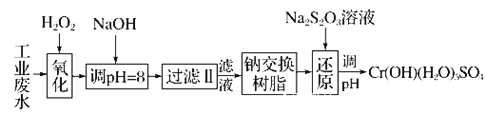
ע�������£�����������������������ʽ��ȫ����ʱ�����pH�����±���
�������� | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
��1�����������пɴ���H2O2������Լ���________(����ĸ����ͬ)��
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
��2������NaOH��Һ������ҺpH��8ʱ����ȥ��������________��
��֪�����ӽ�����֬��ԭ����Mn����nNaR�D��MRn��nNa�����˲�������������ȥ������������____________��
A.Fe3�� B.Al3�� C.Ca2�� D.Mg2��
��3����ԭ���������������½��У�ÿ����0.8 mol Cr2O![]() ת��4.8 mol e�����÷�Ӧ���ӷ���ʽΪ________________________________________________________________________��
ת��4.8 mol e�����÷�Ӧ���ӷ���ʽΪ________________________________________________________________________��
��.���������£����۸���Ҫ��Cr2O![]() ��ʽ���ڣ���ҵ�ϳ��õ�ⷨ������Cr2O
��ʽ���ڣ���ҵ�ϳ��õ�ⷨ������Cr2O![]() �ķ�ˮ���÷���Fe���缫��⺬Cr2O
�ķ�ˮ���÷���Fe���缫��⺬Cr2O![]() �����Է�ˮ�����ŵ����У�������������ҺpH���ߣ�����Cr(OH)3��Һ��
�����Է�ˮ�����ŵ����У�������������ҺpH���ߣ�����Cr(OH)3��Һ��
��1�����ʱ�ܷ���Cu�缫������Fe�缫��________(������������������)��������_____________��
��2�������£�Cr(OH)3���ܶȻ�Ksp��1��10��20��������Һ��c(Cr3��)=0.01mol/L����pHӦΪ______ʱ��ʼ���ɳ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����A����![]() ��
��![]() ��
��![]() ����һ�������¿�ʵ����ͼ��ʾ������֮��ı仯��
����һ�������¿�ʵ����ͼ��ʾ������֮��ı仯��
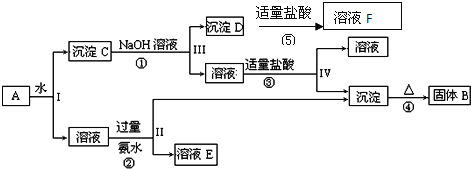
�ݴ˻ش��������⣺
![]() ��II��III��IV�IJ��ж�����Һ�ͳ����ķ����ȡ�ķ�����______��
��II��III��IV�IJ��ж�����Һ�ͳ����ķ����ȡ�ķ�����______��
![]() ����������ͼ��Ӧ��ϵ��д������B��D�������ʵĻ�ѧʽ����B______������D______��
����������ͼ��Ӧ��ϵ��д������B��D�������ʵĻ�ѧʽ����B______������D______��
![]() �
д��![]() �Ļ�ѧ����ʽ _____________��
�Ļ�ѧ����ʽ _____________��
![]() �
�![]() ��
��![]() ������Ӧ�����ӷ���ʽ
������Ӧ�����ӷ���ʽ![]() ___________________��
___________________��![]() _______________��
_______________��
(5)д��![]() �ڹ�ҵ�ϵ�һ����Ҫ��;��_________________��
�ڹ�ҵ�ϵ�һ����Ҫ��;��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾװ�ý���ʵ�飬��Ӧ�����㹻��ʱ���װ��II��ʵ��������ȷ����
�� | �� | �� | II��ʵ������ |
| |
A | Ũ���� | ̼��� | ���з�̪��ϡ̼������Һ | ��Һ�ɺ�ɫ��Ϊdz��ɫ | |
B | Ũ��ˮ | ������ | ����������Һ | ����������ɫ���� | |
C | ������ | �Ҵ���Ũ���� | ����̼������Һ | ��Һ�ֲ㣬�ϲ�Ϊ��״Һ�� | |
D | NH4Cl��Һ | NaAlO2��Һ | ��ɫʯ����Һ | ��Һ����ɫ��Ϊ��ɫ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ֳ�������A(�ؿ��к����ڶ��Ľ���)��B(��ɫ����)�ֱ���������X��Y������Ӧ����ת����ϵ��ͼ��ʾ������DΪ����ɫ���塣
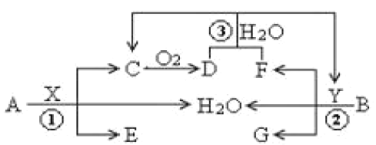
�ش��������⣺
��1����Ӧ�۵����ӷ�Ӧ����ʽΪ___��
��2��6.4gB�����X��Һ(8mol /L��60mL)��ַ�Ӧ�����ɵĻ�ԭ������C��D����Ӧ����Һ������XΪn mol ����ʱ��Һ������X�������ӵ����ʵ���Ϊ___mol��
��3��������A��Y��ϡ��Һ�ܷ�����Ӧ������W�����ڹ���W��ת����ϵ��ͼ��ʾ(����������ȥ)������N�Ǻ���ɫ�Ļ����
��M�����ֻ�������ɣ����к��Уƣ�����ͨ��BaCl2��Һ��ʵ��������___��
��������ӦI�õ�16 g����Σ�����������Mǡ�ñ�0.3L1mol��L��1 NaOH��Һ��ȫ���յ���Һ1����Ӧ���з�����Ӧ�����ӷ���ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
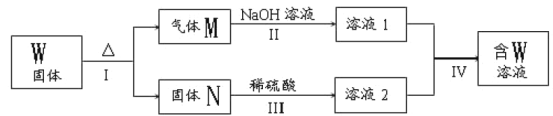
����Ŀ��ij��ѧ��ȤС��Ϊ̽��������������ʣ�����ͼ��ʾװ�ý���ʵ�顣

��ش��������⣺
��1��װ��A��ʢ���������Ƶ�����������__________����Ӧ�Ļ�ѧ����ʽΪ_______________��
��2��װ��B�е�������__________________����Ӧ�����ӷ���ʽΪ_________________��
��3��װ��C�е�������____________________��������˵������������е�������________________________��
��4��װ��D��Ŀ����̽������������Ʒ�����õĿ����ԣ�д��ʵ�����������_____________��
��5��β���ɲ���__________��Һ���ա�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܶ�Ϊ1.25 gmL��1����������Ϊ36.5%��Ũ��������240 mL 0.1 molL��1�����ᣬ��ش��������⣺
��1��Ũ��������ʵ���Ũ��Ϊ________________________��
��2������240 mL 0.1 molL��1������
Ӧ��ȡŨ�������/mL | Ӧѡ������ƿ�Ĺ��/mL |
__________ | __________ |
��3������ʱ������ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ�__________��
A����30 mLˮϴ���ձ��ڱںͲ�����23�Σ�ϴ��Һ��ע������ƿ����
B������Ͳ��ȷ��ȡ�����Ũ���������������ձ��У��ټ�������ˮ��Լ30 mL�����ò���������������ʹ���Ͼ���
C��������ȴ�������ز�����ע������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���12 cm��
��4����ʵ�������������������������������ʵ���Ũ���к�Ӱ�죨�ƫ�ߡ���ƫ�͡����䡱��
������ϡ��������ձ�δϴ��__________________________________________��
������ƿ��ԭ����������ˮ____________________________________________��
�۶���ʱ���ӹ۲�Һ��________________________________________________��
��5����ʵ������г������������δ�����
�ٶ���ʱ������ˮʱ�����˿̶�________________________________________��
��������ƿ��ת����Һʱ��������Һ����________________________________��
�۶���ҡ�Ⱥ���Һ���½�____________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com