
分析 当向蛋白质溶液中加入的非重金属盐溶液达到一定浓度时,反而使蛋白质的溶解度降低而从溶液中析出,这种作用叫盐析,盐析是可逆的.
蛋白质变性是指蛋白质在某些物理和化学因素作用下,从而导致其性质的改变和生物活性的丧失,这种现象称为蛋白质变性,据此分析解答即可.
解答 解:在某些物理因素或化学因素的影响下,蛋白质的性质和生理功能发生改变的现象称为蛋白质的变性.导致蛋白质变性的物理因素有:加热、加压、搅拌、振荡、紫外线照射、超声波等;化学因素有:加强酸、强碱、重金属盐、甲醛等,蛋白质溶液中加入饱和(NH4)2SO4溶液,(NH4)2SO4属于非重金属盐,蛋白质析出,再加水会溶解,属于蛋白质盐析,
故答案为:盐析.
点评 本题考查了蛋白质的性质,难度不大,注意蛋白质的盐析是可逆的,变性是不可逆的.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a}^{a+b}$R | C. | ${\;}_{a-m}^{a+b-m}$R | D. | ${\;}_{a+m}^{a+b+m}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
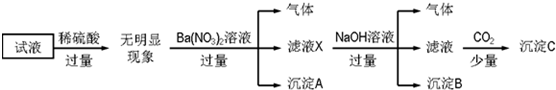
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | 先变红后褪色 |
| b | AgNO3溶液 | 出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应为缩聚反应 | |
| B. | PPV是聚苯乙炔 | |
| C. | PPV与聚苯乙烯的最小结构单元组成相同 | |
| D. | 1 mol  最多可与2 mol H2发生反应 最多可与2 mol H2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
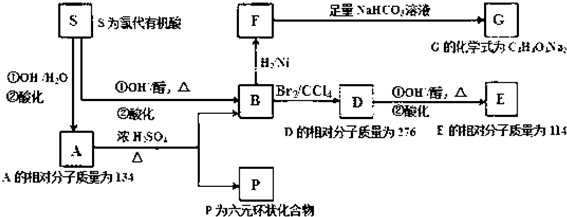
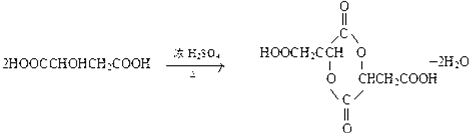 .
.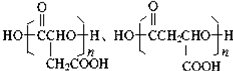 .
.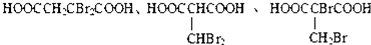 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com