
如图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0. 2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是:
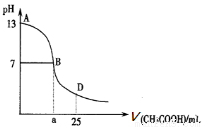
A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:填空题
(4分)我国已对酒驾实行了“醉驾入刑”,酒的主要成分是乙醇。请回答下列问题:
(1)乙醇的官能团是 ;
(2)使用K2Cr2O7酸性溶液检测酒驾,利用了乙醇的 (填“氧化性”或“还原性”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:选择题
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和 为24。则下列判断正确的是
| T | |
X | Y | Z |
A.R位于元素周期表中第二周期第VIA族
B.五种元素中原子序数最大的是X
C.气态氢化物稳定性:T>Y
D.Z元素的最高价氧化物对应的水化物的化学式为H2ZO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东高考佛山市高三二模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.蛋白质溶液、淀粉溶液都属胶体
B.碳纤维、纤维素都是有机高分子
C.花生油,牛油互为同分异构体
D.普通玻璃、石英玻璃、水玻璃都是硅酸盐
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三4月模拟考理综化学试卷(解析版) 题型:填空题
(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。请回答下列问题:
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。请回答下列问题:
①写出该反应的离子反应方程式________________,
②反应中被氧化的HCl的物质的量为________mol。
③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________ molL-1。
(2)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1 molL-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
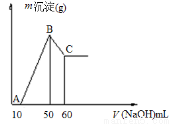
①合金中镁的质量g。
②盐酸的物质的量浓度molL-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:实验题
(14分)某兴趣小组欲利用下列装置探究A反应中Cl2的产生速率。

(1)完善A中反应: KmnO4+ HCl MnCl2+ Cl2 ↑+_ KCl+__
MnCl2+ Cl2 ↑+_ KCl+__
A、B、C装置的接口连接顺序为:①→ → → → (填数字序号)。
(2)当黄绿色气体缓慢进入C时,一段时间后C中溶液才变蓝。C中溶液变蓝前发生反应的离子方程式为____ __;少量淀粉KI溶液的作用是 。
(3)若实验测得速率值偏小,小组同学作如下实验改进和反思,请帮助完成。
I用D装置代替C装置,目的是 ;
Ⅱ导致测得值偏小的原因可能还有:
①Cl2扩散需要一段时间
②___ _(任答一点)。
(4)进一步探究:仅将A装置做如图改变。则此改进欲探究的是 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol Na2O2与水反应转移电子数目为0.1 NA
B.标况下,2. 24 L Cl2含孤电子对的数目为0.2NA
C.pH =2的H2SO4洛液中含H+的数目为0.1 NA
D.在l0g质量分数为17%的氨水中,含有H的数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
一定温度下,向2.0 L恒容密闭容器中充入1.0 mol A,经一段时间后反应A(g) B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.前50 s内B的平均反应速率v(B)=0.0032 mol·L-1·s-1
B.相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大
C.相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆)
D.若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol·L-1,则反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:简答题
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。

请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为 ;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:

该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com