
【题目】下列各组物质中,依次属于单质、酸、盐的一组是
A. 液氯、硝酸、纯碱 B. 干冰、石灰石、氧化钙
C. 钠、烧碱、食盐 D. 氧气、盐酸、熟石灰
科目:高中化学 来源: 题型:
【题目】当光束通过下列物质时,会出现丁达尔效应的是:①消毒用的酒精 ②Fe(OH)3胶体 ③生理食盐水 ④有色玻璃 ⑤云、雾
A.②④⑤B.③④⑤C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7克镁带,按右图连接好装置,从A中加入20.0mL 0.5mol/LH2SO4。记录注射器活塞的位置和相应的时间。记录数据如下:
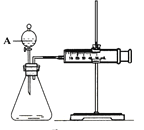
时间/s | 0 | t | 2t | ...... |
活塞的位置/mL | 17.3 | 25.6 | 36.6 | ...... |
(1)检查该装置气密性的方法是 ___________________。
(2)仪器A的名称是__________________________。
(3)0-t时间段与t-2t时间段,化学反应速率最快的是_______,原因是______________。
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3、0.2mol/LCuCl2,完成下表的实验设计:
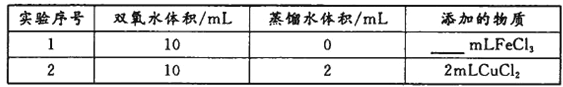
①上表中需要添加的物质是_________mL FeCl3溶液。
②本实验需要测定的数据是____________________________。
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如下表。
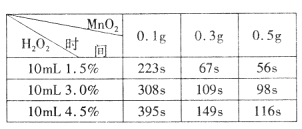
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而_______(填“加快”、“减慢”或“不变”)。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入__________ g的MnO2为较佳选择。
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?______(填“正确”或“不正确”),理由是_____________。(提示:H2O2溶液的密度可认为近似相等。)
(6)50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。
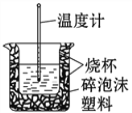
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是____________________,烧杯间填满碎泡沫塑料的作用是____________________________________。大烧杯上如不盖硬纸板,则求得的中和热数值____________(填“偏大” “偏小”或“无影响”)。
(7)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(CH3OCOOCH3,简称 DMC)是一种应用前景广泛的新材料。在密闭容器中按n(CH3OH)∶n(CO2)=2∶1 投料直接合成 DMC,反应方程式为﹕2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g)。一定条件下, 平衡时 CO2 的转化率如图所示。下列说法中不正确的是
CH3OCOOCH3(g)+H2O(g)。一定条件下, 平衡时 CO2 的转化率如图所示。下列说法中不正确的是
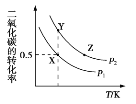
A. 该反应的正反应为放热反应
B. 压强 p2>p1
C. X 点对应的平衡常数为 0.1L/mol
D. X、Y、Z 三点对应的初始反应速率的关系为 Z> Y > X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是硫酸工业尾气的主要成分。以硫酸工业的尾气联合制备硫酸钾和硫酸锰晶体(MnSO4·H2O)的工艺流程如下:

(1)反应Ⅰ的总化学方程式为_______________________________。
(2)反应Ⅱ需控制温度在60~70 ℃,其原因是_______________________。实验室控制温度在60~70 ℃的加热方法是________________。
(3)上述生产工艺中可循环使用的物质是________________。
(4)检验硫酸钾样品中是否含有氯化物杂质的实验操作是_______________________。
(5)已知软锰矿浆的主要成分是MnO2,则反应Ⅳ中氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L的密闭容器中,发生反应4A(s)+3B(g)![]() 2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 用BCD分别表示反应的速率,其比值是3∶2∶1
C. 在第2 min末的反应速率用B表示是0.3 mol·L-1·min-1
D. 在这2 min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
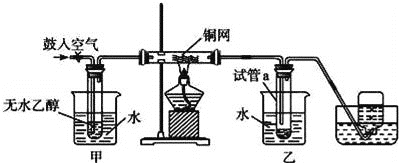
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的总化学方程式_______。
(2)甲和乙两个水浴作用不相同。甲的作用是__________,乙的作用是___________。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是__________;集气瓶中收集到的气体的主要成分是__________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有___。要除去该物质,可先在混合液中加入__________(填写字母),然后再通过蒸馏即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是

A. 选择合适的试剂,用图甲可分别制取少量CO2、CO和SO2
B. 洗涤沉淀时(见图乙),向漏斗中加入适量水至浸没沉淀并滤干,重复2-3次
C. 用图丙所示装置除去HCl中的少量CO2
D. 用图丁装置从KI和I2的固体混合物中回收I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com