
(12分)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
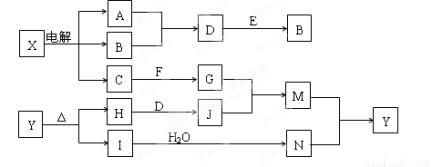
请回答下列问题:(1)B中所含元素位于周期表中第 周期 族。
(2)A在B中燃烧的现象是 。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是 。
(4)G + J → M的离子方程式是 。
(5)Y受热分解的化学方程式是 。
(12分)
(1)三 ⅦA(各1分,共2分)
(2)产生苍白色火焰(2分)
(3)2∶1(2分)
(4)3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓(3分)
(5)4Fe(NO3)3 2Fe2O3+ 12NO2↑+ 3O2↑(3分)
2Fe2O3+ 12NO2↑+ 3O2↑(3分)
【解析】
试题分析:根据题意可知,F是Al,I是NO2,M是Fe(OH)3,X电解产生三种物质,其中C与Al反应,判断X是氯化钠,E、H、I为氧化物,E为黑色固体,A、B是氢气、氯气中的一种,二者反应生成D是HCl的溶液可与MnO2反应生成氯气,所以B是氯气,A是氢气,则C是氢氧化钠,氢氧化钠溶液与Al反应生成氢气外还生成偏铝酸钠,所以G是偏铝酸钠,而M是氢氧化铁,所以J是含铁离子的化合物,由于H与D反应生成J,所以J是氯化铁,I是二氧化氮气体,与水反应生成硝酸,所以N是硝酸,则Y是硝酸铁,硝酸铁分解产生二氧化氮、氧化铁,还有一种物质是氧气,所以H是氧化铁,氧化铁与盐酸反应生成氯化铁J,符合流程图。根据以上分析:
(1)B中的Cl元素位于元素周期表的第三周期第VIIA族;
(2)氢气在氯气中燃烧的现象是产生苍白色火焰;
(3)在MnO2+4HCl(浓)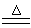 MnCl2+ Cl2↑+2 H2O中,氧化剂是二氧化锰,还原剂是HCl,其中HCl有1/2作还原剂,所以被氧化与被还原的物质的量之比也是还原剂与氧化剂的物质的量之比是2:1;
MnCl2+ Cl2↑+2 H2O中,氧化剂是二氧化锰,还原剂是HCl,其中HCl有1/2作还原剂,所以被氧化与被还原的物质的量之比也是还原剂与氧化剂的物质的量之比是2:1;
(4)偏铝酸钠与氯化铁发生双水解反应生成氢氧化铁沉淀、氢氧化铝沉淀,离子方程式为3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓;
(5)硝酸铁受热分解生成二氧化氮、氧化铁、氧气,化学方程式为4Fe(NO3)3 2Fe2O3+ 12NO2↑+ 3O2↑。
2Fe2O3+ 12NO2↑+ 3O2↑。
考点:考查物质的推断,根据物质的特征判断物质的种类,方程式的书写,原子结构,实验现象的判断


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:选择题
除去FeSO4溶液中少量的硫酸铁,可行的办法是
A.加入铁粉 B.加入铜粉
C.加入氢氧化钠溶液 D.滴入KSCN溶液
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A.Na2S2O3溶液中加入稀硫酸:2S2O32 -+4H+=SO42 -+3S↓+2H2O
B.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
C.FeS溶于过量稀硝酸中:FeS + 2H+= Fe2+ + H2↑
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+2H+=I2+ 2H2O
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.胶体的分散质粒子直径大小介于溶液与浊液之间
B.金属冶炼通常利用氧化还原反应原理
C.陶瓷、水泥和光导纤维均属于硅酸盐材料
D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如下图所示,则溶液中c(Cl?)与c(SO42?)之比为( )
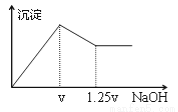
A.1∶1 B.2∶3 C.3∶2 D.2∶1
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解
成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3=5N2+6H2O;
②6NO2+8NH3=7N2+12H2O;③NO+NO2+2NH3=2N2+3H2O下列说法正确的是( )
A.NOx主要来自于汽车尾气的排放,是引起温室效应的主要气体之一
B.N2中π键与σ键之比为1:2
C.反应③中每生成22.4LN2,转移电子数1.5NA
D.NH3的沸点比PH3的沸点高
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
(9分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如下图表达。
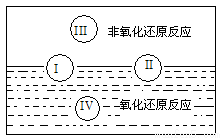
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:___________________,其中水为________剂
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl ____Cu+____CuCl2+N2↑+____H2O。
____Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10, 10C+P4O10===P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源:2015届江西省第一学期高三第一次月考化学(A卷)试卷(解析版) 题型:填空题
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:Cu2O + 2H+ = Cu + Cu2+ + H2O;
部分氢氧化物在溶液中沉淀的pH见下表:
物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.8 | 6.3 | 5.2 |
完全沉淀的pH | 3.0 | 8.3 | 6.7 |
注:金属离子的起始浓度为0.1 mol·L-1 实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为 。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 。
(3)溶液C中除H+、Cu2+外一定还含有另一种阳离子;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是 。
(4)Ⅳ中加NaClO的目的是 。
(5)将Ⅳ中得到的溶液D电解,若电路中有0.1mol电子通过,则理论上阴极质量增重 g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合1: ;组合2:
;……(用化学式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com