
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:Cu2O + 2H+ = Cu + Cu2+ + H2O;
部分氢氧化物在溶液中沉淀的pH见下表:
物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.8 | 6.3 | 5.2 |
完全沉淀的pH | 3.0 | 8.3 | 6.7 |
注:金属离子的起始浓度为0.1 mol·L-1 实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为 。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 。
(3)溶液C中除H+、Cu2+外一定还含有另一种阳离子;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是 。
(4)Ⅳ中加NaClO的目的是 。
(5)将Ⅳ中得到的溶液D电解,若电路中有0.1mol电子通过,则理论上阴极质量增重 g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合1: ;组合2:
;……(用化学式表示)
(1)2Al+2OH-+2H2O === 2AlO2-+3H2↑(2)SiO2
(3)Fe2+;向待测液中滴加K3[Fe(CN)6]溶液,出现蓝色沉淀(或向酸性KMnO4溶液中滴加待测液,褪色。此处不能选KSCN和氯水,因为不确定溶液中是否存在Fe3+)
(4)将Fe2+氧化成Fe3+,增大溶液的pH使Fe3+生成Fe(OH)3沉淀。
(5)3.2
(6)组合1:Al、Fe2O3、Cu2O;2:Al、Cu2O、Fe3O4;3:Al、Fe2O3、Cu2O、Fe3O4。
【解析】
试题分析:(1)取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B,说明样品含有Al,则Ⅰ中产生气体的离子方程式为:2Al+2OH-+2H2O === 2AlO2-+3H2↑。
(2)加足量NaOH溶液,得无色溶液B,如果含有SiO2,与NaOH反应生成Na2SiO3,向B中加入稀硫酸,出现白色沉淀,生成H2SiO3,H2SiO3不溶于硫酸,沉淀不能完全溶解,所以原样品一定不含SiO2。
(3)过滤得到蓝绿色溶液D,说明原样品含有Cu2O,Cu2O与稀硫酸反应生成Cu和Cu2+,Cu能把Fe3+还原为Fe2+,所以溶液C一定还含有Fe2+;检验Fe2+的试剂及对应现象为:向待测液中滴加K3[Fe(CN)6]溶液,出现蓝色沉淀,或向酸性KMnO4溶液中滴加待测液,褪色。
(4)溶液C中含有Fe2+,所以Ⅳ中加NaClO的目的是:将Fe2+氧化成Fe3+,增大溶液的pH使Fe3+生成Fe(OH)3沉淀。
(5)溶液D为CuSO4溶液,电解时阴极方程式为:Cu2++2e?=Cu,则n(Cu)=1/2n(e?)=1/2×0.1mol=0.05mol,所以阴极增加的质量等于Cu的质量:0.05mol×64g/mol=3.2g。
(6)根据上述推断,原样品一定含有Al、Cu2O,可能含有Fe2O3或Fe3O4,所以原样品所有可能的成分组合为组合1:Al、Fe2O3、Cu2O;2:Al、Cu2O、Fe3O4;3:Al、Fe2O3、Cu2O、Fe3O4。
考点:本题考查无机物的推断、离子的检验、离子方程式的书写、电解的计算。


科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:填空题
(12分)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
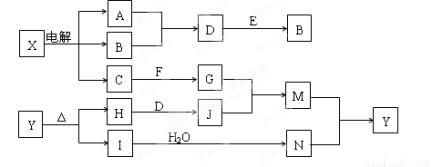
请回答下列问题:(1)B中所含元素位于周期表中第 周期 族。
(2)A在B中燃烧的现象是 。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是 。
(4)G + J → M的离子方程式是 。
(5)Y受热分解的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
D.和Ba(OH)2溶液反应的离子方程式:Fe3++SO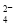 +Ba2++3OH-===Fe(OH)3↓+BaSO4↓
+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列金属冶炼的反应原理,错误的是 ( )
A.MgO+H2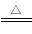 Mg+ H2O B.Fe3O4+4CO
Mg+ H2O B.Fe3O4+4CO  3 Fe +4 CO2
3 Fe +4 CO2
C. 2NaCl(熔融)  2Na +Cl2↑ D.2HgO
2Na +Cl2↑ D.2HgO  2 Hg+ O2↑
2 Hg+ O2↑
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
根据如图,可判断出下列离子方程式中错误的是 ( )
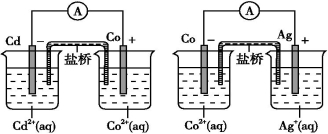
A.2Ag(s)+Cd2+(aq) 2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s)
2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s) Co(s)+Cd2+(aq)
Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s) 2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s)
2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s) 2Ag(s)+Co2+(aq)
2Ag(s)+Co2+(aq)
查看答案和解析>>
科目:高中化学 来源:2015届江西省第一学期高三第一次月考化学(A卷)试卷(解析版) 题型:选择题
.把V L含有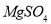 和
和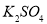 的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含?b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含?b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A. 
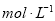 B.
B. 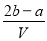
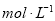
C. 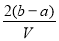
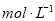 D.
D. 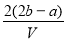
查看答案和解析>>
科目:高中化学 来源:2015届江西省第一学期高三第一次月考化学(A卷)试卷(解析版) 题型:选择题
下列溶液中微粒浓度关系一定正确的是( )
A.均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者
B.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
C.25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者
D.25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市三校高三上第一次联考化学试卷(解析版) 题型:选择题
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为b mol。下列叙述中正确的是
A.溶质的质量分数为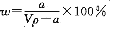
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
C.溶液中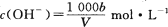
D.溶质的物质的量浓度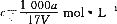
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com