
下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
D.和Ba(OH)2溶液反应的离子方程式:Fe3++SO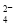 +Ba2++3OH-===Fe(OH)3↓+BaSO4↓
+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解
成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3=5N2+6H2O;
②6NO2+8NH3=7N2+12H2O;③NO+NO2+2NH3=2N2+3H2O下列说法正确的是( )
A.NOx主要来自于汽车尾气的排放,是引起温室效应的主要气体之一
B.N2中π键与σ键之比为1:2
C.反应③中每生成22.4LN2,转移电子数1.5NA
D.NH3的沸点比PH3的沸点高
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
(9分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如下图表达。
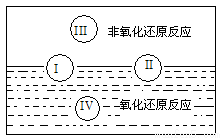
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:___________________,其中水为________剂
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl ____Cu+____CuCl2+N2↑+____H2O。
____Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10, 10C+P4O10===P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
在过量的稀硫酸溶液中加入5.6g铁粉,待反应完全后,再加入50 mL 0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:__FeSO4+__KNO3+__H2SO4===__K2SO4+__Fe2(SO4)3+__NxOy +__H2O,则对该反应的下列说法正确的是( )。
A.反应中还原产物是NO
B.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
C.反应过程中转移的电子数为8e-
D.氧化产物和还原产物的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B.强电解质的水溶液导电性强于弱电解质的水溶液
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.强电解质易溶于水,弱电解质难溶于水
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为 ( )
A.1.5 mol·L-1 B.0.5 mol·L-1 C.2 mol·L-1 D. 1.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届江西省第一学期高三第一次月考化学(A卷)试卷(解析版) 题型:填空题
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:Cu2O + 2H+ = Cu + Cu2+ + H2O;
部分氢氧化物在溶液中沉淀的pH见下表:
物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.8 | 6.3 | 5.2 |
完全沉淀的pH | 3.0 | 8.3 | 6.7 |
注:金属离子的起始浓度为0.1 mol·L-1 实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为 。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 。
(3)溶液C中除H+、Cu2+外一定还含有另一种阳离子;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是 。
(4)Ⅳ中加NaClO的目的是 。
(5)将Ⅳ中得到的溶液D电解,若电路中有0.1mol电子通过,则理论上阴极质量增重 g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合1: ;组合2:
;……(用化学式表示)
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市高三8月月考化学试卷(解析版) 题型:填空题
(8分)将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
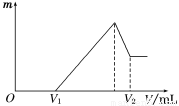

(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com