
下列说法正确的是( )
A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B.强电解质的水溶液导电性强于弱电解质的水溶液
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.强电解质易溶于水,弱电解质难溶于水
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:填空题
(15分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体
NH4Al(SO4)2?12H2O,其工艺流程图如下:
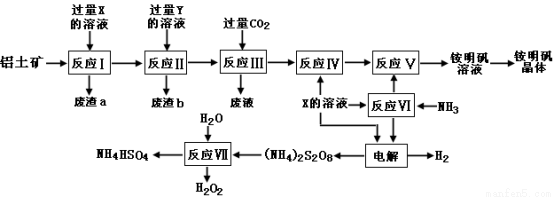
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:________________________ ____。
(5)反应Ⅶ的化学方程式为:_________________________ _____________;
NH4HSO4溶液中离子浓度由大到小顺序为:__________________________ _。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓
B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2
C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓
D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
只用胶头滴管和试管,不用其他试剂就可以区别的下列溶液(浓度均为0.1mol·L-1,)是
A.CaCl2和Na2CO3 B.稀盐酸和K2CO3 C.Ba(OH)2和NaHCO3 D.AgNO3和盐酸
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
D.和Ba(OH)2溶液反应的离子方程式:Fe3++SO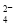 +Ba2++3OH-===Fe(OH)3↓+BaSO4↓
+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(8分)某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)肯定不存在的离子是___________________________。
(2)写出步骤②中生成沉淀和气体的反应的离子方程式____________________;
(3)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?______(填“有”或“无”)。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列金属冶炼的反应原理,错误的是 ( )
A.MgO+H2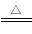 Mg+ H2O B.Fe3O4+4CO
Mg+ H2O B.Fe3O4+4CO  3 Fe +4 CO2
3 Fe +4 CO2
C. 2NaCl(熔融)  2Na +Cl2↑ D.2HgO
2Na +Cl2↑ D.2HgO  2 Hg+ O2↑
2 Hg+ O2↑
查看答案和解析>>
科目:高中化学 来源:2015届江西省第一学期高三第一次月考化学(A卷)试卷(解析版) 题型:选择题
.把V L含有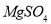 和
和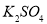 的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含?b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含?b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A. 
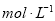 B.
B. 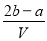
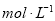
C. 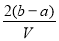
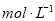 D.
D. 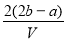
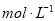
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市高三8月月考化学试卷(解析版) 题型:填空题
(6分)在宏观—微观—符号之间建立联系,是化学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。如用●表示碳原子,用○表示氧原子,用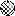 表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:
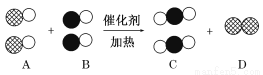
(1)A、B、C三种物质可以归为一类的依据是___________________________________。
(2)将C归为化合物,将D归为单质的理由是__________________________________。
(3)用化学反应方程式表示为________________________________。
化学变化过程中消耗的A物质和生成的C物质的质量比为________。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com