
(15分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体
NH4Al(SO4)2?12H2O,其工艺流程图如下:
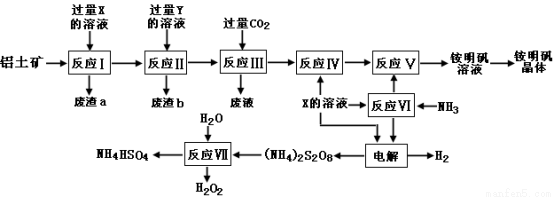
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:________________________ ____。
(5)反应Ⅶ的化学方程式为:_________________________ _____________;
NH4HSO4溶液中离子浓度由大到小顺序为:__________________________ _。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓
B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2
C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓
D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓
(1)二氧化硅(1分)、氢氧化铁(1分)
(2)H2SO4 (1分)
(3)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓(2分);蒸发浓缩(2分)。
(4)2SO42- - 2e-=S2O82-(2分)
(5)(NH4)2S2O8+2H2O=2NH4HSO4+H2O2(2分);
c(H+)>c(SO42-)>c(NH4+)>c(OH-) (2分)
(6) B(2分)
【解析】
试题分析:根据铝土矿的成分和流程图中反应III通入CO2,可推知X为H2SO4,Y为NaOH。
(1)铝土矿加入过量硫酸溶液,得到的废渣a为:二氧化硅;再通入过量的NaOH溶液,Fe2(SO4)3与NaOH反应得到的废渣b为:氢氧化铁。
(2)根据上述分析,流程图中X的化学式为:H2SO4
(3)由工艺流程转化可知,反应III为向含有AlO2-的的滤液中通入过量CO2气体,使AlO2-完全转化为Al(OH)3,在溶液中CO2、AlO2-、H2O反应生成Al(OH)3与HCO3-,反应离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;从铵明矾溶液中获得铵明矾晶体的操作依次为:蒸发浓缩、冷却结晶、过滤洗涤。
(4)根据电解原理阳极失电子发生氧化反应,SO42?失电子生成S2O82-,电极方程式为:2SO42--2e-═S2O82-。
(5)由工艺流程转化可知,反应Ⅶ是H2O与(NH4)2S2O8反应产生H2O2和NH4HSO4,反应方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2;NH4HSO4溶液中NH4+发生部分水解反应,生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(NH4+)>c(OH-)。
(6)设NH4Al(SO4)2为2mol,溶液中含有2molNH4+、2molAl3+、4molSO42-,Al3+完全沉淀时,需要3molBa(OH)2,此时发生2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓,故C项可能;如SO42-完全反应,则需要4molBa(OH)2,此时发生NH4Al(SO4)2+2Ba(OH)2=NH3?H2O+2BaSO4↓+Al(OH)3↓,故D项可能;如Al3+完全转化为AlO2-,则需要5molBa(OH)2,此时发生2NH4Al(SO4)2+5Ba(OH)2=2NH3?H2O+4BaSO4↓+Ba(AlO2)2+4H2O,则n(NH4Al(SO4)2):n(Ba(OH)2)<2时,生成产物为(NH4)2SO4、BaSO4↓、Al(OH)3,可能含有Al2(SO4)3,故A项可能;n(NH4Al(SO4)2):n(Ba(OH)2) =2时,生成产物为NH3?H2O、BaSO4和Al(OH)3,故B项不可能发生。
考点:本题考查化学流程的分析、基本操作、电解原理、离子浓度比较、化学反应的判断。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:实验题
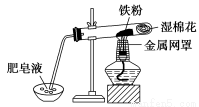
(15分)新型材料纳米级铁粉与普通铁粉具有不同的性质。已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4。
(1)写出温度高于570℃时反应的化学方程式
。
(2)中学教材中用下图所示实验装置,完成铁粉与水蒸气反应的演示实验。实验中使用肥皂液的作用是 。
(3)如果提供给你3支试管、水槽、蒸发皿、胶塞、导管、酒精灯及其必要的仪器和物品,请在答题卷的方框中画出你设计的实验装置示意图(包括反应时容器中的物质)。
说明:①本题装置示意图中的仪器可以用下面的方式表示。
水槽: 试管:
试管: 蒸发皿:
蒸发皿: 玻璃导管:
玻璃导管: 或
或 (但应标示出在液面上或液面下)
(但应标示出在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的联接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,标以“△”表示。
(4)甲同学对实验后的黑色固体产物X含有哪些物质进行了如下实验:
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 取少量黑色固体产物X(假定成分分布均匀)放入试管中,加入盐酸,微热。 | 黑色粉末逐渐溶解,有少量气泡产生。 |
Ⅱ | 取实验Ⅰ反应后的溶液少许,滴加几滴KSCN溶液,振荡。 | 溶液没有出现血红色。 |
Ⅲ | 取实验Ⅰ反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡。 | 高锰酸钾溶液褪色。 |
根据以上实验事实,能确定固体X中存在的物质是 ,但不能确定X的成分,原因是 。
(5)乙同学为了探究实验后的固体产物是否存在Fe3O4设计下列实验方案:
①取固体样品m1 g,溶于足量的稀盐酸;
②向①反应后的溶液中加入足量H2O2的和氨水,充分反应后,过滤、洗涤、干燥;
③将②中所得固体进行灼烧,得到红棕色固体m2 g。
溶液X中发生氧化还原反应的离子方程式为 ;m1与m2的比值在 范围内时,才能确定固体样品中一定存在Fe3O4。
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三第一次调研考试化学试卷(解析版) 题型:选择题
体积为V mL,密度为d g/mL,溶质的摩尔质量为M g·mol-1,物质的量浓度为c mol·L-1,溶质的质量分数为a%,溶质的质量为m g。下列式子正确的是( )
A.m=aV/100d B.c=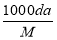
C.c=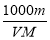 D.a%=
D.a%=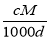 %
%
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三年级摸底考试理综化学试卷(解析版) 题型:填空题
(15分)高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O 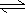 4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____ ________________。
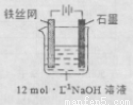
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为____ ,正极反应为:____ 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____ mol。
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A.原子半径的大小顺序为W>Q>Z>X>Y
B.元素X的气态氢化物与Q的单质可发生置换反应
C.元素X与Y可以形成5种以上的化合物
D.元素Q的最高价氧化物对应的水化物酸性比W的强
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A.Na2S2O3溶液中加入稀硫酸:2S2O32 -+4H+=SO42 -+3S↓+2H2O
B.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
C.FeS溶于过量稀硝酸中:FeS + 2H+= Fe2+ + H2↑
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+2H+=I2+ 2H2O
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如下图所示,则溶液中c(Cl?)与c(SO42?)之比为( )
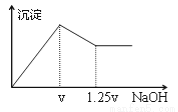
A.1∶1 B.2∶3 C.3∶2 D.2∶1
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B.强电解质的水溶液导电性强于弱电解质的水溶液
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.强电解质易溶于水,弱电解质难溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com