
在过量的稀硫酸溶液中加入5.6g铁粉,待反应完全后,再加入50 mL 0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:__FeSO4+__KNO3+__H2SO4===__K2SO4+__Fe2(SO4)3+__NxOy +__H2O,则对该反应的下列说法正确的是( )。
A.反应中还原产物是NO
B.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
C.反应过程中转移的电子数为8e-
D.氧化产物和还原产物的物质的量之比为1∶4
B
【解析】
试题分析:n(Fe)=0.1mol,所以n(FeSO4)=0.1mol;在反应中失去电子0.1mol,n(KNO3)= 0.050 L ×0.5mol/L=0.025mol,根据电子转移数目相等可知在反应中N原子得到的电子是0.1mol÷0.025mol=4,所以反应后N的化合价为+1价,因此反应后N2O,选项A错误;根据氧化还原反应中电子守恒及化学反应在的元素守恒可得方程式是8FeSO4+2KNO3+5 H2SO4==K2SO4+4 Fe2(SO4)3+N2O+5H2O,所以选项B正确;在反应过程中转移的电子数为0.1NAe-,选项C错误;在该反应在氧化产物Fe2(SO4)3和还原产物N2O的物质的量之比为4∶1,错误。
考点:考查氧化还原反应的配平、电子转移、概念等知识。


科目:高中化学 来源:2015届河北省唐山市高三年级摸底考试理综化学试卷(解析版) 题型:选择题
已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液pH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A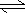 H++HA-,HA-
H++HA-,HA- 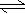 H++A2-
H++A2-
B.(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-)
C.0.0lmol·L-l的H2A溶液pH=2
D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
某碱金属R与其氧化物R2O的混合物2.16g,跟足量水充分反应后,将所得溶液蒸干,得固体3.2 g,由此判定金属是( )
A.锂 B.钠 C.钾 D.铷
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
在反应3Cl2 + 8NH3 → 6NH4Cl + N2中,设阿伏加德罗常数为NA。则下列说法正确的是
A.若有0.3 mol Cl2参加反应,转移的电子数为0.6NA
B.若生成2.24 L氮气,转移的电子数为0.6NA
C.若有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g
D.若生成1 mol的氯化铵转移电子数是n个,则NA=1/n
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:填空题
(8分)(一)下列各组离子在指定溶液中一定能大量共存的是___________________。
①无色溶液中:K+、Na+、MnO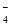 、SO
、SO
②甲基橙呈黄色的溶液中:I-、Cl-、NO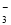 、Na+
、Na+
③石蕊呈蓝色的溶液中:Na+、AlO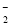 、NO
、NO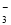 、HCO
、HCO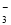
④在pH=1的溶液中:Fe2+、NO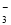 、SO
、SO 、Na+
、Na+
⑤在pH=0的溶液中:Na+、NO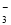 、SO
、SO 、K+
、K+
⑥在pH=12的溶液中:K+、Cl-、HCO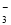 、Na+
、Na+
⑦含大量OH-的溶液中:CO 、Cl-、F-、K+
、Cl-、F-、K+
⑧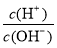 =1012的溶液中:NH
=1012的溶液中:NH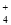 、Al3+、NO
、Al3+、NO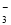 、Cl-
、Cl-
⑨加入Al能放出H2的溶液中:Cl-、HCO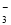 、SO
、SO 、NH
、NH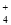
⑩由水电离出的c(OH-)=10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO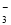
?c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO 、SCN-
、SCN-
?含大量Al3+的溶液中:K+、Na+、NO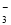 、ClO-
、ClO-
(二)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为____________。
(2)写出该反应的化学方程式_____________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是_______________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
D.和Ba(OH)2溶液反应的离子方程式:Fe3++SO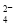 +Ba2++3OH-===Fe(OH)3↓+BaSO4↓
+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:实验题
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4?5H2O):
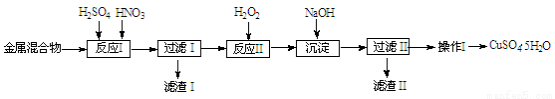
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Cu2+ |
开始沉淀 | 1.5 | 6.4 | 4.2 |
完全沉淀 | 3.2 | 8.9 | 6.7 |
(1)滤渣Ⅰ的主要成份是(写化学式)__________。
(2)反应Ⅱ中加入H2O2的作用是___________________。
(3)生成沉淀反应的离子方程式有______________________。
(4)操作Ⅰ的步骤是 、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
A. 准确称取3.125g胆矾晶体样品配成100mL溶液;
B. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:2Cu2+ +4Iˉ= 2CuI↓ + I2
C. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O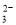 = 2Iˉ+S4O
= 2Iˉ+S4O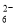 , 则样品中胆矾晶体的质量分数______。
, 则样品中胆矾晶体的质量分数______。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
根据如图,可判断出下列离子方程式中错误的是 ( )
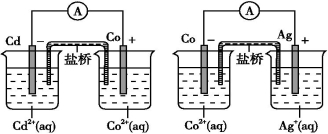
A.2Ag(s)+Cd2+(aq) 2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s)
2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s) Co(s)+Cd2+(aq)
Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s) 2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s)
2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s) 2Ag(s)+Co2+(aq)
2Ag(s)+Co2+(aq)
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.天然气、乙醇和水煤气分别属于化石能源、不可再生能源和二次能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com