
(8分)(一)下列各组离子在指定溶液中一定能大量共存的是___________________。
①无色溶液中:K+、Na+、MnO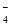 、SO
、SO
②甲基橙呈黄色的溶液中:I-、Cl-、NO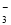 、Na+
、Na+
③石蕊呈蓝色的溶液中:Na+、AlO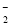 、NO
、NO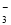 、HCO
、HCO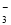
④在pH=1的溶液中:Fe2+、NO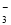 、SO
、SO 、Na+
、Na+
⑤在pH=0的溶液中:Na+、NO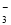 、SO
、SO 、K+
、K+
⑥在pH=12的溶液中:K+、Cl-、HCO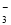 、Na+
、Na+
⑦含大量OH-的溶液中:CO 、Cl-、F-、K+
、Cl-、F-、K+
⑧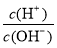 =1012的溶液中:NH
=1012的溶液中:NH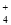 、Al3+、NO
、Al3+、NO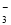 、Cl-
、Cl-
⑨加入Al能放出H2的溶液中:Cl-、HCO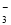 、SO
、SO 、NH
、NH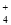
⑩由水电离出的c(OH-)=10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO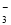
?c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO 、SCN-
、SCN-
?含大量Al3+的溶液中:K+、Na+、NO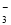 、ClO-
、ClO-
(二)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为____________。
(2)写出该反应的化学方程式_____________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是_______________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________________________(填化学式)。
(一)⑦⑧ (2分)
(二)(1)1∶2 (1分); (2)3NF3+5H2O===2NO+HNO3+9HF (2分)
(3)产生红棕色气体、产生刺激性气味气体、产生白雾 (2分) (4)NaNO3
【解析】
试题分析:(一)①MnO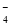 是紫色的,在无色溶液中不能大量存在,错误;②使甲基橙呈黄色的溶液可能是酸性溶液,在酸性溶液中:I-、NO
是紫色的,在无色溶液中不能大量存在,错误;②使甲基橙呈黄色的溶液可能是酸性溶液,在酸性溶液中:I-、NO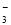 会发生氧化还原反应而不能大量共存,错误;③使石蕊呈蓝色的溶液是碱性溶液,在碱性溶液中:OH-和 HCO
会发生氧化还原反应而不能大量共存,错误;③使石蕊呈蓝色的溶液是碱性溶液,在碱性溶液中:OH-和 HCO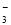 会放出反应而不能大量存在,错误;④在pH=1的溶液中:H+和Fe2+、NO
会放出反应而不能大量存在,错误;④在pH=1的溶液中:H+和Fe2+、NO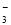 会发生氧化还原反应而不能大量存在,错误;⑤ pH=0的溶液是强酸性溶液,在该溶液中: NO
会发生氧化还原反应而不能大量存在,错误;⑤ pH=0的溶液是强酸性溶液,在该溶液中: NO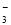 、SO
、SO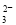 、和H+会发生氧化还原反应而不能大量共存,错误;⑥ pH=12的溶液是强碱性溶液,在该溶液中OH-、HCO
、和H+会发生氧化还原反应而不能大量共存,错误;⑥ pH=12的溶液是强碱性溶液,在该溶液中OH-、HCO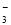 会发生反应而不能大量共存,错误;⑦含大量OH-的溶液中:CO
会发生反应而不能大量共存,错误;⑦含大量OH-的溶液中:CO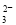 、Cl-、F-、K+不会发生任何反应,可以大量共存,正确;⑧
、Cl-、F-、K+不会发生任何反应,可以大量共存,正确;⑧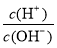 =1012的溶液是酸性溶液,在该溶液中:NH
=1012的溶液是酸性溶液,在该溶液中:NH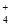 、Al3+、NO
、Al3+、NO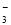 、Cl-+不会发生任何反应,可以大量共存,正确;⑨加入Al能放出H2的溶液可能呈酸性也可能呈碱性,在酸性溶液中: HCO
、Cl-+不会发生任何反应,可以大量共存,正确;⑨加入Al能放出H2的溶液可能呈酸性也可能呈碱性,在酸性溶液中: HCO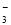 、会发生反应而不能大量存在;在碱性溶液中HCO
、会发生反应而不能大量存在;在碱性溶液中HCO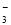 、NH
、NH 会发生离子反应而不能大量共存,错误;⑩由水电离出的c(OH-)=10-14 mol/L的溶液可能呈酸性也可能呈碱性,无论是酸性还是碱性溶液中HCO
会发生离子反应而不能大量共存,错误;⑩由水电离出的c(OH-)=10-14 mol/L的溶液可能呈酸性也可能呈碱性,无论是酸性还是碱性溶液中HCO 都会发生离子反应而不能大量存在,错误;?c(Fe3+)=0.1 mol/L的溶液中:Fe3+与SCN-会发生络合反应而不能大量存在,错误;?含大量Al3+的溶液是酸性溶液,在酸性溶液中: ClO-会发生离子反应产生HClO而不能大量存在,错误。故各组离子在指定溶液中一定能大量共存的是⑦⑧;(二)三氟化氮(NF3)和水蒸气反应的化学方程式是:3NF3+5H2O=9 HF+2NO+HNO3,反应过程中,被氧化的N元素与被还原的N元素原子的物质的量之比为1:2;NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现反应产生的NO被空气氧化为NO2,而使气体呈红棕色,而且硝酸在空气中形成酸雾,HF是无色有刺激性气味的气体,故选项是产生红棕色气体、产生刺激性气味气体、产生白雾;(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,NO2发生反应产生其产物除NaNO2、NaNO3、HF与碱反应产生NaF。所以其产物除NaNO2、NaF、H2O外,还肯定有NaNO3。
都会发生离子反应而不能大量存在,错误;?c(Fe3+)=0.1 mol/L的溶液中:Fe3+与SCN-会发生络合反应而不能大量存在,错误;?含大量Al3+的溶液是酸性溶液,在酸性溶液中: ClO-会发生离子反应产生HClO而不能大量存在,错误。故各组离子在指定溶液中一定能大量共存的是⑦⑧;(二)三氟化氮(NF3)和水蒸气反应的化学方程式是:3NF3+5H2O=9 HF+2NO+HNO3,反应过程中,被氧化的N元素与被还原的N元素原子的物质的量之比为1:2;NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现反应产生的NO被空气氧化为NO2,而使气体呈红棕色,而且硝酸在空气中形成酸雾,HF是无色有刺激性气味的气体,故选项是产生红棕色气体、产生刺激性气味气体、产生白雾;(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,NO2发生反应产生其产物除NaNO2、NaNO3、HF与碱反应产生NaF。所以其产物除NaNO2、NaF、H2O外,还肯定有NaNO3。
考点:考查离子的检验与共存、氧化还原反应的计算、物质的检验及产物的判断的知识。


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:2015届河北省唐山市高三年级摸底考试理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1) COCl2的空间构型为 ;溴的价电子排布式为 。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
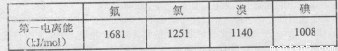
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。
(4)下列分子既不存在s-p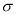 键,也不存在p-p
键,也不存在p-p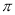 键的是 。
键的是 。
A. HCl B.HF C.SO2 D.SCl2
(5)已知ClO2一为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为
,写出CN-的等电子体的分子式 (写出1个)。
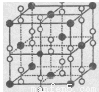
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构如图所示:由此可判断该钙的氧化物的化学式为____ 。已知该氧化物的密度是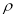 g·cm-3,则晶胞离得最近的两个钙离子间的距离为____ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
g·cm-3,则晶胞离得最近的两个钙离子间的距离为____ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol?L-1和1.5
mol?L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是( )
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
下列化学反应的离子方程式正确的是( )
A.氢氧化镁中滴加盐酸:H++OH-=H2O
B.用FeCl3溶液腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+
C.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++HCO3-+2OH- NH3?+CO32-+2H2O
NH3?+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
化学是一门实用性的学科,以下叙述正确的是( )
A.新型能源生物柴油和矿物油主要化学成分相同
B.“洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳
C.静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体
D.铝热反应中可得到铁,工业上可以利用该反应来大量生产铁
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
在过量的稀硫酸溶液中加入5.6g铁粉,待反应完全后,再加入50 mL 0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:__FeSO4+__KNO3+__H2SO4===__K2SO4+__Fe2(SO4)3+__NxOy +__H2O,则对该反应的下列说法正确的是( )。
A.反应中还原产物是NO
B.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
C.反应过程中转移的电子数为8e-
D.氧化产物和还原产物的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
根据下列方程式(1)2Fe2++Cl2===2Fe3++2Cl-;(2)HClO+H++Cl-===Cl2+H2O;(3)2Fe3++Cu===2Fe2++Cu2+; (4)Fe+Cu2+===Fe2++Cu。判断下列各组物质氧化性强弱顺序正确的是( )。
A. HClO>Cl2>Fe3+>Cu2+>Fe2+ B.Fe3+>HClO>Cl2>Fe2+>Cu2+
C.Cl2>HClO>Fe3+>Cu2+>Fe2+ D.HClO>Fe3+>Cl2>Cu2+>Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是
A.有铜无铁 B.有铁无铜 C.有铁有铜 D.无铁无铜
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列对三种有机物的叙述不正确的是(—SH的性质类似于—OH)
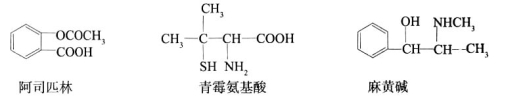
A.三种有机物都能发生酯化反应
B.青霉氨基酸不能与盐酸反应,但能与NaOH反应
C.麻黄碱的分子式为C10H15ON,苯环上的一氯代物有3种
D.阿司匹林能与适量NaOH反应生成可溶性阿司匹林
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com