
【题目】(I)某原料经测定主要含有A、B、C、D四种原子序数依次增大的短周期元素,其相关信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
请回答下列问题(用A、B、C、D、所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为__________________________________
(2)![]() 常用作除锈剂,该分子中B的杂化方式为_____;1 mol
常用作除锈剂,该分子中B的杂化方式为_____;1 mol ![]() 分子中含有σ键与π键的数目之比为_____。
分子中含有σ键与π键的数目之比为_____。
(3) ![]() 分子中均含有18个电子,它们的沸点相差较大,主要原因是_____________________
分子中均含有18个电子,它们的沸点相差较大,主要原因是_____________________
(Ⅱ)化学与生活密切相关。K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O![]() (橙色)+CH3CH2OH
(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(4)基态Cr 原子的价电子排布图为__________________________________
(5)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为________________。
(6)ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有____________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
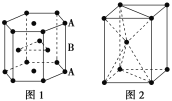
(7)锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。锌的堆积方式为_____________________,配位数为_______。
【答案】N>O>C ![]() 7:2
7:2 ![]() 分子间形成氢键
分子间形成氢键  根据离子的核外电子排布可判断由于d轨道上没有未成对电子(3d轨道上电子为全空或全满),所以Sc3+、Zn2+的水合离子为无色。 AC 六方最密堆积 12
根据离子的核外电子排布可判断由于d轨道上没有未成对电子(3d轨道上电子为全空或全满),所以Sc3+、Zn2+的水合离子为无色。 AC 六方最密堆积 12
【解析】
Ⅰ.根据题干信息,A是元素周期表中原子半径最小的元素,则A为H元素,B的原子核外有三种不同的能级且各个能级所填充的电子数相同,则B为C元素,C的最外层p轨道半充满,则C为N元素,D位于短周期,其原子的核外成对电子数是未成对电子数的3倍,则D为O元素,据此分析解答;
Ⅱ.根据核外电子排布规律书写电子排布图,由配合物结构分析配合物中粒子间的作用力,根据均摊法得出原子配位数。
Ⅰ.(1)由上述分析可知,B、C、D分别为C、N、O,由于N原子的最外层p轨道半充满,所以N的第一电离能最大,O原子的半径小于C原子,则第一电离能N>O>C;
(2)A2B2D4为H2C2O4,其结构式为![]() ,分子中C原子的杂化方式为sp2,1molH2C2O4分子中含有7molσ键与2molπ键,数目之比为7:2;
,分子中C原子的杂化方式为sp2,1molH2C2O4分子中含有7molσ键与2molπ键,数目之比为7:2;
(3)N2H4分子间可形成氢键,因此其沸点高于C2H6;
Ⅱ.(4)基态Cr原子核外有24个电子,其核外电子排布式为[Ar]3d54s1,则其价电子排布图为 ;
;
(5)根据离子的核外电子排布可判断,由于Sc3+、Zn2+的d轨道上没有未成对电子(3d轨道上电子为全空或全满),所以Sc3+、Zn2+的水合离子为无色;
(6)Fe2+与[Zn(OH)Cl2]-之间虽然形成离子键,在溶液中发生电离以离子形式存在,离子键被破坏,所以[Fe[Zn(OH)Cl2]2的水溶液中以离子形式存在,没有离子键,Fe[Zn(OH)Cl2]2是配合物,存在配位键、共价键,水分子间还有范德华力和氢键,故Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有离子键和金属键,答案选AC;
(7)根据Zn的堆积方式可知,Zn的堆积方式为六方最密堆积,六方最密堆积的配位数为12。


科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.在火柴头浸取的水溶液中滴入AgNO3溶液,稀硝酸溶液检验氯元素时离子反应:Ag++Cl-=AgCl↓
B.NaNO2溶液中滴加适量稀盐酸:2![]() +2H+=H2O+NO↑+NO2↑
+2H+=H2O+NO↑+NO2↑
C.向Cu(NO3)2溶液中加入过量氨水:Cu2++2NH3H2O= Cu(OH)2↓+2![]()
D.苯酚与三氯化铁溶液反应,得到溶液显紫色:6C6H5O-+Fe3+=[Fe(OC6H5)6]3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
A. Na2NO2是氧化剂,NH4Cl是原剂
B. N2既是氧化产物,又是还原产物
C. NH4Cl中氮元素被还原
D. 每生成1molN2转移电子的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G,以A为原料的合成路线如下图所示。

回答下列问题:
(1)D、G分子中的官能团名称分别__________、__________。
(2)在反应①~⑥中,属于加成反应的是______,属于取代反应的是_____。(填序号)
(3)写出与G分子式相同的所有羧酸类的同分异构体:_________________
(4)写出由C与新制氢氧化铜反应的化学方程式:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用天然气水蒸气重整制备H2的反应为![]()
![]() 每次只改变一种条件(X),其它条件不变,CH4的平衡转化率
每次只改变一种条件(X),其它条件不变,CH4的平衡转化率![]() 随X的变化趋势如图所示。下列说法正确的是
随X的变化趋势如图所示。下列说法正确的是
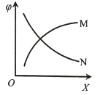
A.某条件下,若CH4(g)、H2O(g)初始浓度均为0.2 mol/L,![]() = 25%,则K=3
= 25%,则K=3
B.X为投料比![]() 时,
时,![]() 的变化趋势为曲线N
的变化趋势为曲线N
C.X为压强时,![]() 的变化趋势为曲线M
的变化趋势为曲线M
D.X为温度时,![]() 的变化趋势为曲线N
的变化趋势为曲线N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
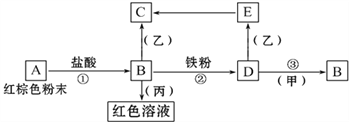
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中A12O3的含量。查阅资料得知,铝土矿的主要成分是A12O3 ,杂质是Fe2O3、SiO2等。从铝土矿中提取A12O3的过程如下:
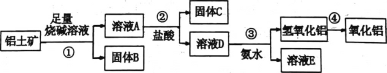
(1)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:______。
(2)第②步用到的分离方法是_______。
(3)请从下面仪器中选出第④步操作不需要的仪器_____________(填字母)
A.蒸发皿 B.玻璃棒 C.泥三角 E.酒精灯 F.坩埚
(4)将实验过程中所得固体准确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中A12O3 的质量分数__________(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法错误的是
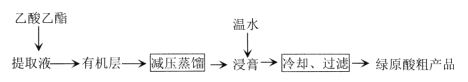
A.常温下,绿原酸易溶于水
B.浸膏的主要成分是绿原酸
C.减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质
D.绿原酸粗产品可以通过重结晶进一步提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)![]() Sn(s,白) △H3=+2.1kJmol-1
Sn(s,白) △H3=+2.1kJmol-1
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com