
【题目】4molL﹣1的KOH溶液100mL,取出5mL,这5mL溶液中K+浓度为( )
A.4 molL﹣1
B.0.2molL﹣1
C.2 molL﹣1
D.0.4 molL﹣1
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列分子或离子①F- ②Na+ ③HF ④NH3⑤CH4其中与氖原子含有相同电子数的是( )
A. ①②③ B. ②③④ C. ①②⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合你所学的知识模拟该过程,下列哪种材质的手术刀触碰铁盘上的青蛙腿不会产生触动_________(填字母)。
a、铝 b、玻璃 c、银 d、铁
(2)1799年,伏打仔细研究了伽伐尼的发现,以含食盐水的湿抹布,夹在银和锌的圆形版中间,堆积成圆柱状,制造出世界上最早的电池-伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
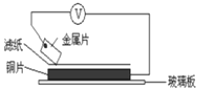
金属 | 电子流动方向 | 电压(V) |
A | A→Cu | +0.78 |
B | Cu→B | -0.15 |
D | D→Cu | +1.35 |
E | E→Cu | +0.30 |
已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据表中数据判断:_______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,下图是丹尼尔电池的简易装置:
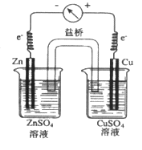
该电池的正极反应是_____________,负极反应 __________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它的正极反应为:Fe3++e-=Fe2+以“![]() ”代表反应容器,“
”代表反应容器,“![]() ”代表导线,“
”代表导线,“![]() ”代表电极,“
”代表电极,“![]() ”代表小灯泡,
”代表小灯泡,
在下图方框内画出装置图并指出电极材料和电解质溶液,标出电源的正负极________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL浓度为2mol/L的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是( )
A. 加入适量的6mol/L的硫酸 B. 适当加热
C. 加入适量蒸馏水 D. 加入适量的稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在右图所示的装置(代替量热计)中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
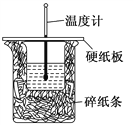
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________。
(2)烧杯间填满碎纸条的作用是___________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
(5)实验中改用 50mL 0.50 mol· L-1的醋酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。简述理由______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)在一定条件下将CO2和H2转化为甲醇蒸气和水蒸气的相关反应有:
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H1=+41KJ/mol
CO(g)+H2O(g) △H1=+41KJ/mol
CO(g)+2 H2(g)![]() CH3OH(g) △H2=-90KJ/mol
CH3OH(g) △H2=-90KJ/mol
则由甲醇蒸气和水蒸气转化为CO2和H2的热化学方程式为___________________。
(2)在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3<0.
CH3OH(g)+H2O(g) △H3<0.
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
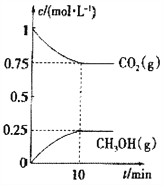
①能说明该反应已达平衡状态的是______________。
A.单位时间内有3nmolH—H键断裂,同时又有2nmolO—H键断裂
B.混合气体的平均相对分子质量不随时间变化
C.混合气体的密度不随时间变化
D.体系中n(CO2)/n(H2)=1∶1,且保持不变
②下列措施能使n(CH3OH)/n(CO2)增大的是__________。
A.升高温度B.恒温恒容下,再充入2molCO2、3molH2
C.使用高效催化剂 D.恒温恒容充入He(g)使体系压强增大
③已知该温度下此反应的平衡常数K=0.198,若使K的值变为1,应采取的措施是___________。
A.升高温度 B.降低温度 C.增大压强 D.恒压加入一定量H2
(3)捕捉CO2可以利用Na2CO3溶液。用100mL0.1 mol/LNa2CO3溶液完全捕捉0.44gCO2气体(溶液体积不变),所得溶液中c(HCO3-)+c(CO32-)+c(H2CO3)=__________mol/L
(4)用CO2和天然气可以制备CO和H2,CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4 的平衡转化率与温度及压强的关系如图所示,则压强P1 ____P2(填“>”或“<”)。若P2=3MPa,则T°C时该反应的平衡常数Kp =_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4 的平衡转化率与温度及压强的关系如图所示,则压强P1 ____P2(填“>”或“<”)。若P2=3MPa,则T°C时该反应的平衡常数Kp =_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某核苷酸与核苷酸长链的示意图,据图回答问题:

(1)已知图甲的分子结构式右上角的含氮碱基为腺嘌呤(A)。请观察后回答下列问题:
图甲所示的核苷酸的名称是_________。该核苷酸是构成______的原料。
(2)图乙为一条核苷酸长链的片段,据图回答:
①图中所示1、2、3的名称分别是___、___、_____。4、5的名称分别是__、__。
②此结构中与另一种核酸相比较,其特有的碱基中文名称是_________。
(3)将水稻根细胞中的遗传物质彻底水解后,可得到
A.一种五碳糖B.四种脱氧核糖核苷酸C.5种含氮碱基D.8种核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物H是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:
(1) E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色
(2) H的结构简式为
(3) RCOOH![]() (R为烃基)
(R为烃基)
(4) 
请回答下列问题:
(1)A的苯环上有____种不同化学环境的氢原子。
(2)④的反应条件是________该反应的类型是_______;l molH最多可以和____mol NaOH 反应。
(3)G的结构简式为__________。
(4)D在一定条件下可以聚合形成高分子,写出该反应的化学方程式__________。
(5)E有多种同分异构体,同时满足下列条件的E且含有苯环的同分异构体有_____种。
①能发生银镜反应 ②能发生水解反应 ③分子中含的环只有苯环
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2 为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe2O3、Al2O3两种固体混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
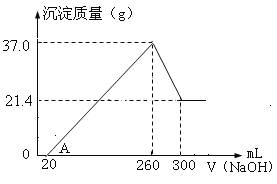
(1)原混合物中Fe2O3的质量是____________g。
(2)所用NaOH溶液物质的量浓度为___________。
(3)稀硫酸物质的量浓度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com