
【题目】下列反应中,属于加成反应的是
A.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
C.2CH3CH2OH+O2![]() 2CH3CHO +2H2O
2CH3CHO +2H2O
D.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】请用下图所示的装置设计实验,验证浓硫酸与木炭粉反应产生的各种产物。
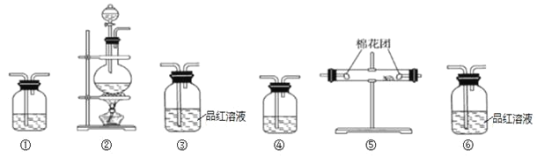
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是_______。
(2)实验装置的连接顺序(按产物气体从左至右的流向)是:_______→_______→③→④→_______→_______(填装置序号)。
(3)实验时可观察到装置③中溶液褪色,装置⑥中溶液不褪色,装置⑥的作用是_______。
(4)装置④中所盛溶液可能是_______(填选项字母)。
a.饱和Na2CO3溶液 b.饱和NaHCO3溶液 c.NaOH溶液 d.酸性KMnO4溶液
(5)装置⑤中所加的固体药品是_______(填化学式)。
(6)装置①中所盛溶液的溶质是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业酸性废水中的![]() 可转化为
可转化为![]() 除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为
除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为![]() 的起始浓度、电压、电解时间均相同),下列说法中,不正确的是( )
的起始浓度、电压、电解时间均相同),下列说法中,不正确的是( )
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨,滴加 | 阴极为石墨,阳极为铁,滴加 |
| 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高![]() 的去除率
的去除率
B. 实验②中,![]() 在阴极放电的电极反应式是
在阴极放电的电极反应式是![]()
C. 实验③中,![]() 去除率提高的原因是阳极产物还原
去除率提高的原因是阳极产物还原![]()
D. 实验③中,理论上电路中每通过![]() 电子,则有
电子,则有![]()
![]() 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)具有复合官能团的复杂有机物,其官能团具有各自的独立性,在不同条件下所具有的化学性质可分别从各官能团讨论。如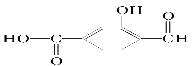 具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
(2)羟基的电子式是___________________________。
(3)(CH3CH2)2C(CH3)2的名称为_________________________。
(4)2-甲基-1,3-丁二烯的键线式___________________________。
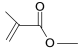
(5)![]() 该有机物发生加聚反应后,所得产物的结构简为______。
该有机物发生加聚反应后,所得产物的结构简为______。
(6) 分子式为_______________________结构简式为______________________。
分子式为_______________________结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。下列说法不正确的是

A. 该过程可循环利用的物质是I2和HI
B. 该过程总反应的化学方程式SO2 + 2H2O=H2SO4 + H2
C. X物质是I2
D. SO2 在过程中表现出了还原性与漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-===PbSO4正极PbO2+4H++SO42-+2e-===PbSO4+2H2O
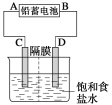
(1)请写出电解饱和食盐水的化学方程式____________。
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明铅蓄电池的B极为___极。
(3)用铅蓄电池电解2 L饱和食盐水(电解过程假设体积不变)
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
③若消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的物质的量浓度为(假设氯气全部排出)______________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是

A.外电路电流方向为:X—外电路—Y
B.若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ |
(1)写出下列元素的元素符号: ④_________、⑧ __________(填具体元素符号,下同);⑤正一价阳离子的结构示意图是________________。
(2)最高价氧化物是两性氧化物的元素是___________;它的最高价氧化物对应水化物与⑤的最高价氧化物对应水化物溶液反应的离子方程式为_______________________________。
(3)①、②两元素形成的最简单化合物的结构式为________________________,该化合物是由_________(填“极性”“非极性”)键形成的。
(4)④⑦二种元素中非金属性强的是___________。
(5)检验元素⑨的方法是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 mLAl2(SO4)3溶液中,含Al3+1.62 g,在该溶液中加入0.1molL﹣1Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
A. 0.4molL﹣1B. 0.3molL﹣1C. 0.2molL﹣1D. 0.1molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com