
【题目】某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
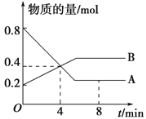
(1)该反应的化学方程式为___________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆) (填“>”、“<”或“=”)。
【答案】(1)2A![]() B
B
(2)0.05 mol·L-1·min-1
(3)否 =
【解析】
(1)由图像可看出A为反应物,B为生成物,物质的量不变时反应达到平衡状态,A反应的物质的量=0.8mol-0.2mol=0.6mol;B生成的物质的量=0.5mol-0.2mol=0.3mol,所以A、B转化的物质的量之比为2:1,根据A、B转化的物质的量之比=化学方程式的计量数之比,反应的化学方程式为:2A![]() B。
B。
(2)反应开始至4min时,A物质的量变化=0.8mol-0.4mol=0.4mol,A的平均反应速率为0.4mol÷2L÷4min=0.05 molL-1min-1。
(3)由图像分析可知,4 min时随时间变化A、B物质的量发生变化,说明未达到平衡;8 min时随时间变化A、B物质的量不再发生变化,说明达到平衡,故v(正)=v(逆)。


科目:高中化学 来源: 题型:
【题目】右图表示反应N2(g)+3H2(g)![]() 2NH3(g); ΔH=-92.2kJ/mol。 在某段时间t0~ t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( )
2NH3(g); ΔH=-92.2kJ/mol。 在某段时间t0~ t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( )

A、t0—t1 B t2—t3 C t3—t4 D t5—t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平2NO2(g)![]() N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法不正确的
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法不正确的
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变大 D. 容器内气体颜色先变深后变浅,最后比原来还要深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的下列说法不正确的是( )
A. 某温度下,Ba(OH)2溶液中Kw=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,充分反应后,混合溶液的pH=6
B. 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-可能大量存在
C. 往0.1mol/LNH4Cl溶液中不断加入NaOH固体,随着NaOH的加入,![]() 不断减小
不断减小
D. 一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末(不考虑热效应),则溶液中c(Ca2+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶……“。从化学角度考虑文中未涉及的操作方法是( )
A.溶解B.渗析C.过滤D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )

A. N4属于一种新型的化合物B. N4分子中存在极性键
C. N4分子中N—N键角为109°28′D. 1 mol N4转变成N2将放出882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
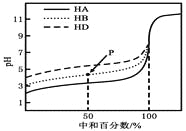
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:
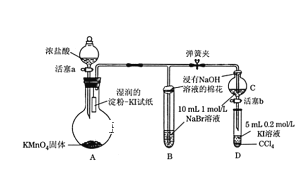
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:
(1)A中产生黄绿色气体,其电子式是_________。实验室在加热条件下制取该气体的离子方程式为____________。
(2)验证氯气的氧化性强于碘单质的实验现象是____________。
(3)C中溶液发生反应的离子方程式是_______________。
(4)过程Ⅲ实验的目的:甲同学认为试管B的作用就是吸收尾气,防止多余Cl2污染空气,因此B中盛装的最佳试剂应该为__________________________
乙同学经分析认为,B中溶液由黄色变为棕红色,发生反应为Cl2+2NaBr=2NaCl+Br2,以此说明C中________,从而得出D中氧化I-的氧化剂必为_______,因此B装置是必不可少的。
(5)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象为______________,发生反应的离子方程式为_____________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的本质原因:同主族元素从上到下_________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液
D. 滤液加稀盐酸时只发生反应:H+ +OH- =H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com