
【题目】关于溶液的下列说法不正确的是( )
A. 某温度下,Ba(OH)2溶液中Kw=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,充分反应后,混合溶液的pH=6
B. 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-可能大量存在
C. 往0.1mol/LNH4Cl溶液中不断加入NaOH固体,随着NaOH的加入,![]() 不断减小
不断减小
D. 一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末(不考虑热效应),则溶液中c(Ca2+)减小
【答案】D
【解析】
A.该温度下中性溶液中的pH=6,pH=8的氢氧化钡溶液中氢氧根离子浓度为10-4mol/L,pH=4的氢离子浓度为10-4mol/L,二者等体积混合,二者恰好反应导致溶液呈中性,故正确;B.由水电离出的氢离子浓度为10-13 mol/L,氢离子浓度小于10-7 mol/L,说明水的电离被抑制,溶液可能是碱溶液,如是碱溶液,溶液中几种离子可以大量共存,故正确;C.铵根离子水解显酸性,结合水解平衡常数分析, ,随着氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则
,随着氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则![]() 减小,故正确;D.一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末,氧化钙和水反应,会有氢氧化钙固体析出,溶液仍然是饱和溶液,所以溶液中钙离子浓度不变,故错误。故选D。
减小,故正确;D.一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末,氧化钙和水反应,会有氢氧化钙固体析出,溶液仍然是饱和溶液,所以溶液中钙离子浓度不变,故错误。故选D。


科目:高中化学 来源: 题型:
【题目】与铁相似,金属锡能与盐酸反应生成氯化亚锡(SnCl2),氯化亚锡又能被氯化铁氧化为氯化锡(SnCl4)。则下列有关粒子氧化性和还原性强弱的比较中,正确的是
A.氧化性:Sn4+<Sn2+B.氧化性:Fe3+<Sn4+
C.还原性:Fe2+<Sn2+D.还原性:Fe<Sn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)D中所含官能团的名称是_____________。
(2)反应③的化学方程式是_________________________________。
(3)G是一种高分子化合物,可以用来制造农用薄膜材料等,其结构简式是___________。
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27℃)进行应急处理。A制备F的化学方程式是_____________。
(5)B与D反应加入浓硫酸的作用是_________;为了得到较纯的E,需除去E中含有的D,最好的处理方法是_____________(用序号填写)。
a.蒸馏 b.用过量饱和碳酸钠溶液洗涤后分液 c.水洗后分液 d.用过量氯化钠溶液洗涤后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于研究物质性质的基本程序的步骤顺序正确的是( )
①观察物质的外部特征
②实验和观察
③解释和结论
④预测物质的性质
A.①④②③B.①②③④C.②①③④D.①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:25℃时,CaCO3的Ksp=2.8×10-9,现将Na2CO3浓度为2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A. 2.8×10-2mol·L-1 B. 5.6×10-5mol·L-1
C. 2.8×l0-5 mol·L-1 D. 1.4×l0-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
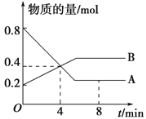
(1)该反应的化学方程式为___________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆) (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______、_______________。他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: ___________________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________(填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com