
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

【答案】 Zn-2e-=Zn2+ 2Fe3++Cu=2Fe3++Cu2+ 铜(或Cu) Fe3++e-=Fe2+ O2+2H2O+4e-=4OH- 2mol
【解析】(1)原电池的负极发生失去电子的氧化反应,则负极是锌失去电子,反应式为Zn-2e-=Zn2+。(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为2Fe3++Cu=2Fe3++Cu2+;铜失去电子,作还原剂,因此若将此反应设计或原电池,则负极所用电极材料为铜,正极铁离子得到电子,反应为Fe3++e-=Fe2+。(3)氧气得到电子,在正极通入,该电池的正极反应式为O2+2H2O+4e-=4OH-,若该电池工作时溶液中增加1molH2O,根据氧原子守恒消耗0.5mol氧气,则理论上电路中通过电子的物质的量为0.5mol×4=2mol。


科目:高中化学 来源: 题型:
【题目】碱式碳酸铜(Cu2(OH)2CO3)是名贵的矿物宝石孔雀石的主要成分,应用广泛,如在无机工业中用于制造各种铜化合物,有机工业中用作有机合成催化剂等等,某化学小组为了探究碱式碳酸铜生成条件对其产率的影响,设计了如下实验:
设计原理:取一定体积的碳酸钠溶液(0.5mol/L)于100mL烧杯中,进行加热,恒温后将硫酸铜溶液(5.00mL,0.5mol/L)在不断搅拌下以一定速度逐滴加入到上述碳酸钠溶液中,反应达平衡后,静止,减压过滤,洗涤,烘干,即得到最终产品,同时有气体放出。
(1)反应原理为:________________________________ 。
(2)探究反应原料用量比对反应产物的影响。
该化学小组根据所提供试剂设计两个实验,来说明反应原料用量对产品的影响。
提供试剂:0.5mol/LNa2CO3溶液、0.5mol/L CuSO4溶液
①填写下表的空白处:_____________、_____________。

②通过实验画图可知:当比值为_____________ ,碱式碳酸铜产量最好。

(3)反应温度对产率的影响
在三支试管中各加入2.0 mL 0.5 mol·L-1CuSO4溶液,另取四支试管各加入由上述实验得到的合适用量的0.5 mol·L-1 Na2CO3溶液。从这两列试管中各取一支将它们分别置于室温、30℃、50℃、100℃的环境中,数分钟后将CuSO4溶液倒入Na2CO3溶液中振荡并观察现象,发现:沉淀颜色分别为蓝色沉淀,绿色沉淀,深绿色沉淀,绿色中带有黑色沉淀,实验结果也如上图所示,请思考,为什么温度过高产率反而下降________________,该实验加热方式为_______________________。
(4)分析所制得的碱式碳酸铜的质量分数。
将已准确称量的0.5g试样放入300mL的锥形瓶中,加入5mL醋酸加热使其溶解,再用100mL水将其稀释。加入2.5gKI振荡混合,经过5分钟后,加入数滴淀粉溶液,用0.1mol/L的硫代硫酸钠溶液进行滴定。当_____________________ 时即达滴定的终点。
(5)反应的原理:2Cu2+ + 4I— == 2CuI + I2 ,I2+2 S2O32— == 2 I—+ S2O6 2—。 若消耗0.1mol/L硫代硫酸钠40 mL,则试样中铜的质量百分率为________________ 。
该溶液的滴定度为______________。(每毫升标准溶液相当于被测物质的质量,单位是g/mL或mg/mL)(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、锌、稀硫酸、导线可组成原电池,则负极上发生的反应是
A. Cu-2e-=Cu2+ B. Zn-2e-=Zn2+ C. 2H2O+O2+4e-=4OH- D. 2H++2e-=H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:
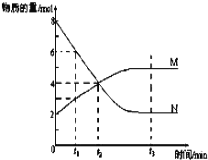
(1)该反应的化学方程式是____________________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,
发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:

环己醇、环己烯的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物中有机物的质量分数
Ⅰ:制备环己烯粗品。实验中将环己醇与浓硫酸混合加入烧瓶中,按图所示装置,油浴加热,蒸馏约1h,收集馏分,得到主要含环己烯和水的混合物。

Ⅱ:环己烯的提纯。主要操作有;
a.向馏出液中加入精盐至饱和;
b.加入3~4mL5%Na2CO3溶液;
c.静置,分液;
d.加入无水CaCl2固体;
e.蒸馏
回答下列问题:
(1)油浴加热过程中,温度控制在90℃以下,蒸馏温度不宜过高的原因是________。
(2)蒸馏不能彻底分离环己烯和水的原因是_______________。
(3)加入精盐至饱和的目的是_____________________。
(4)加入3~4mL5%Na2CO3溶液的作用是__________。
(5)加入无水CaCl2固体的作用是______________。
(6)利用核磁共振氢谱可以鉴定制备的产物是否为环己烯,环己烯分子中有_______种不同环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,室温时甲、乙两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下止水夹K,使两瓶内气体充分接触后,容器内压强最小的是( )
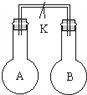
编号 | A | B | C | D |
甲中气体 | H2S | H2 | NH3 | NO |
乙中气体 | SO2 | Cl2 | HCl | O2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com