
【题目】常温下,向10mL1mol·L-1元酸HA溶液中,不断滴加1mol·L-1的NaOH溶液所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Kα(HA)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 溶液的导电性逐渐增强
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】高温、催化剂条件下,某反应达到平衡,平衡常数K=c(CO)·c(H2O)/c(CO2)·c(H2)恒容时,温度升高,H2浓度减小.下列说法正确的是
A. 该反应的焓变为负值
B. 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
C. 2CO2(g)+2H2(g)2CO(g)+2H2O(g) 的平衡常数K1=K2
D. 若恒容、恒温下充入CO,则K值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S燃料电池应用前景非常广阔,该电池示意图如下。下列说法正确的是( )
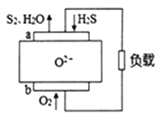
A. 电极a是正极 B. O2-由电极a移向电极b
C. 电极 a 的反应式为:2H2S+2O2--4e-=S2+2H2O D. 当通入1.12LO2,转移电子数0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.标准状况下,1mol任何物质的体积约为22.4L
B.O2的摩尔质量是32g/mol,所以2molO2的质量是64g
C.氯化氢气体的摩尔质量与NA 个氯化氢分子的质量在数值上相等
D.1mol氢气和氧气的混合气体中含有的分子数为6.02×1023 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述,不正确的是( )
A. 新制的氯水中,溶质既有分子又有离子
B. 新制的氯水是无色透明的液体,有酸性和漂白性
C. 光照氯水有气泡逸出,该气体是O2
D. 氯水放置数天后酸性将增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。请回答下列问题:

(1)写出A中反应的化学方程式 ________。
(2)B中选用的试剂是_______,其作用是_______;C 中选用的试剂是________,其作用是_______。
(3)装置E的目的是________,写出 E 中发生反应的化学方程式:_________。
(4)但实验发现D中得到的无水CuCl2总是偏蓝色,请你提出改进方案:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,工业上由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(Na2MoO42H2O)的流程如下:

(1) Na2MoO42H2O中Mo元素的化合价为____;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为________。
(2)流程中由Na2MoO4溶液获得晶体的操作是_________、过滤、洗涤、干燥。加入Na2CO3溶浸时发生的主要反应的离子方程式为______________。
(3)操作1中,所得Na2MoO4溶液中含SO42+杂质,其中c(MoO42+)0.80mol/L,c(SO42-)=0.04mol/L在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当 BaMoO4开始沉淀时,SO42-的去除率是______。[Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,溶液体积变化可忽略]
(4)工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是_____。
(5)高纯Mo可用于制造电池级MoS2,Li-MoS2电池是一种性能优异的二次电池,其电池反应为:xLi+nMoS2![]() Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需帮助水质检测站配制480mL0.1mol·L-1Na2CO3溶液以备使用。
(1)该同学应选择___mL的容量瓶,容量瓶使用前要____。
(2)其操作步骤如图甲所示,则图乙操作应在图甲中的___(填选项字母)之间。
A.②与③ B.①与② C.④与⑤

(3)该同学应称取Na2CO3·10H2O固体_____g。
该操作有如下几步:
A.将游码拨至相应处; B.将游码拨至“0”处; C.在天平两边的托盘上各放一张干净的等质量的滤纸,调节天平两边的螺母使天平平衡; D.取走药品,将砝码放回砝码盒内; E.往左盘内逐步添加晶体至天平平衡; F.在右盘上放置砝码。
其正确的操作顺序是(填字母):B―→(____)―→F―→A―→(____)―→(____)―→B。
(4)关于配制该溶液的说法,分析正确的是____(填序号)
①整个配制过程中,容量瓶不振荡,会使溶液浓度偏高;
②托盘天平只能粗略地称量物质的质量,量筒只能粗略地量取液体的体积,严格地说,它们都不能与容量瓶——精确仪器配套使用;
③引流时,玻璃棒不能靠在瓶口上;
④称量的固体(或量取的液体)可直接放入容量瓶中溶解(或稀释);
⑤定容摇匀后,若液面低于刻度线,可再次加水补充;
⑥选用的容量瓶内有少量蒸馏水,会使配制的溶液浓度偏低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一个容积为2 L的真空密闭容器中(事先装入催化剂)通入1 mol N2和3 mol H2,3 min后测得密闭容器内的压强是起始时的0.7倍,在此时间内v(H2)是
A. 0.1mol/(L·min) B. 0.2mol/(L·min)
C. 0.3mol/(L·min) D. 0.6mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com