
【题目】如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶。长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)

A. NH3 B. HCl C. NO2(假设不含N2O4) D. SO2
科目:高中化学 来源: 题型:
【题目】将3.2 g Cu投入100 mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2,金属Cu逐渐溶解,则下列说法正确的是( )
A. 反应过程中有刺激性气味的气体生成
B. H2O2对Cu和稀硫酸的反应起催化作用
C. 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5 mol·L-1
D. 反应中硫酸既表现出酸性又表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用如图装置进行NO、NO2的性质实验,按下列步骤进行(装置气密性已检验完毕)。
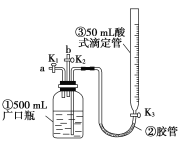
Ⅰ.向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加水的主要操作为____________________________。
(2)从导管a通入一定量的NO,并测得NO体积为V L(V<0 mL,气体体积已经换算为标准状况)。测定NO体积的主要操作为_______________________________。
Ⅱ.验证NO的还原性;探究工业生产硝酸的原理
(3)停止通入NO后关闭K1、K3;打开K2,从导管b缓缓通入O2,可观察到的现象是___________________________________________________________;
写出对应现象的化学方程式:________________________________。
(4)继续通入O2,打开K3,并及时调整酸式滴定管③中液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
①当通入氧气的体积为![]() 时,则广口瓶①的气体体积为________;
时,则广口瓶①的气体体积为________;
②当广口瓶①中刚好充满液体时,所得液体的物质的量浓度为_____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的容器中,反应2X(g)![]() Y(g)+2Z(g)达到平衡时,X、Y和Z的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向右移动的是
Y(g)+2Z(g)达到平衡时,X、Y和Z的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向右移动的是
A. 均减少1mol B. 均增加1mol C. 均减半 D. 均加倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )

A. 途径②增大O2浓度可提高SO2转化率
B. 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C. 途径②中SO2和SO3均属于酸性氧化物
D. 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2(g)为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4-+H+ ka1 HC2O4-
HC2O4-+H+ ka1 HC2O4-![]() C2O42-+H+
C2O42-+H+![]() 常温下向某浓度的草酸溶液中逐滴加入一定量浓度KOH溶液,所得溶液H2C2O4、HC2O4-、C2O42-三种微粒物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
常温下向某浓度的草酸溶液中逐滴加入一定量浓度KOH溶液,所得溶液H2C2O4、HC2O4-、C2O42-三种微粒物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
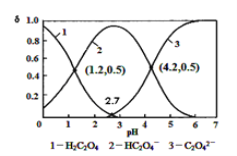
A. pH=1.2溶液中:c(K+)+c(H+) = c(OH-)+c(H2C2O4)(由图知)
B. pH=2.7溶液中: 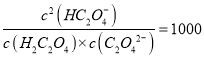
C. 将相同物质的量KHC2O4和K2C2O4固体溶于水可配得pH为4.2混合液
D. 向pH=1.2溶液中滴加KOH溶液,pH增大至4.2的过程中水电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。

(1)按气体流向由左到右排列,各装置的连接顺序为(填写A~E序号):__接__接___接__接__。
(2)装置连接好后,应该首先进行的实验操作是____________________________________________。
(3)A装置烧瓶中反应的离子方程式是_________________________________________。
(4)E中盛装的试剂是________,其作用是_________________________________________。
(5)停止反应后,还有铁丝剩余。为检验FeCl3的生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解,________(填操作方法)除去不溶物;
b.取少量滤液,滴加________溶液,溶液呈现红色,以此检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。
(6)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式)__________________________________________________________________。
你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液________。
A.KMnO4(H+) B.Fe C.H2O2 D.Cl2 E.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A. 7.1 g Cl2与足量的NaOH溶液反应生成NaClO转移的电子数为0.1NA
B. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子的数目为NA
C. 常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D. 足量Fe与22.4 L Cl2反应,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的有机化合物A(C6H6O)是重要的化工原料,在工业上能合成紫外线吸收剂BAD和治疗心脏病药物的中间体F,合成路线如下:
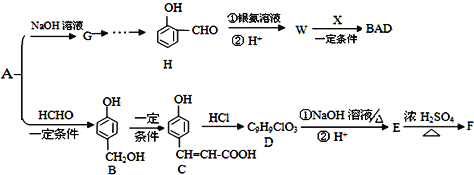
已知:BAD的结构简式为: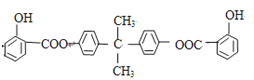
F的结构简式为: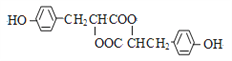
试回答:
(1)H中含有的官能团名称是____________________。
(2)写出X的结构简式____________________________________,推测B的核磁共振氢谱中显示有__________种不同化学环境的氢原子。
(3)写出反应类型A→B______________;W→BAD______________。
(4)1mol C可以和______________mol Br2反应。
(5)C→D的过程中可能有另一种产物C1,请写出在加热条件下C1与足量稀NaOH水溶液反应的化学方程式:__________________________。
(6)B与HCHO在一定条件下反应生成高分子化合物的原理,与酚醛树脂的制备原理相似。请写出该反应的化学方程式___________________。
(7)W的同分异构体有多种,写出所有符合以下要求的W的同分异构体:________________。
①与FeCl3溶液反应,溶液呈紫色; ②能发生银镜反应;③苯环上的一氯代物只有两种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com