
【化学 ——选修3:物质结构】(15分)
氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥形,沸点为-129 ℃;可在铜 催化作用下由F2和过量NH3反应得到。NF3属于________晶体.
催化作用下由F2和过量NH3反应得到。NF3属于________晶体.
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N。
①与N互为等电子体的分子、离子有______、________(各举1例),由此可推知N的空间构型是______形。
②叠氮化物、氰化物能与Fe3+、Cu2+及Co3+等形成络合物,如Co[(N3)(NH3)5]SO4、[Fe(CN)6]4-。写出钴原子在基态时的价电子排布式:__________。如Co[(N3)(NH3)5]SO4、中钴的配位数为________,CN-中C原子的杂化类型是________。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)===2Na(l)+3N2(g),有关说法正确的是________(选填序号)。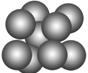
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.常温下,氮气很稳定,是因为氮的电负性小 |
科目:高中化学 来源: 题型:阅读理解
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】
| ||
| 2 |
| ||
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】



| ||
| ||
| 233g/mol |
| (4.03×10-8 cm)3NA |
| 233g/mol |
| (4.03×10-8 cm)3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
2+ 0.45 |
3+ 0.5 |
2+ 0.25 |
3+ 0.70 |
2+ 0.15 |
3+ 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com