
【题目】某气态链烃能使溴水褪色,经测定0.1 mol该烃充分燃烧可以生成7.2 g水,请据此回答下列问题。
(1)通过计算确定该烃具有的分子式__________。
(2)请写出满足上述条件的所有物质的同分异构体并用系统命名法命名__________。
【答案】C4H8 CH2=C(CH3)2;CH2=CHCH2CH3;CH3CH=CHCH3;2-甲基丙烯;1-丁烯;2-丁烯
【解析】
(1)根据烃充分燃烧可以生成7.2g水计算H原子的个数,气态链烃能使溴水褪色确定碳原子个数,由此判断该烃分子式;(2)根据分子式和该烃的性质确定烃的结构。
(1)0.1mol该烃充分燃烧可以生成7.2g水,水物质的量n=![]() =0.4mol,所以1mol烃反应生成4mol水, 说明1mol烃分子中含有8molH, 可能为C3H8、C4H8、C5H8等,因为气态链烃能使溴水褪色,说明碳原子数小于等于4,且为不饱和烃,所以判断分子式为C4H8,为烯烃;答案:C4H8;
=0.4mol,所以1mol烃反应生成4mol水, 说明1mol烃分子中含有8molH, 可能为C3H8、C4H8、C5H8等,因为气态链烃能使溴水褪色,说明碳原子数小于等于4,且为不饱和烃,所以判断分子式为C4H8,为烯烃;答案:C4H8;
(2)该烃存在支链的结构简式CH2=C(CH3)2,名称为:2-甲基丙烯;直链烃有CH2=CHCH2CH3,名称为1-丁烯;CH3CH=CHCH3,名称为2-丁烯;答案:CH2=C(CH3)2;CH2=CHCH2CH3;CH3CH=CHCH3;2-甲基丙烯;1-丁烯;2-丁烯。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】在容积相同的两个密闭容器M和N中,保持温度为150 ℃,向M容器中加入a mol HI,同时向N容器中加入b mol HI (a>b)。当反应2HI(g)![]() H2 (g) + I2 (g) 达到平衡后,下列说法正确的是
H2 (g) + I2 (g) 达到平衡后,下列说法正确的是
A.从反应开始到达到平衡,所需时间tM > tN
B.平衡时cM(I2) = c N(I2)
C.平衡时I2 蒸气在混合气体中的体积分数:M > N
D.HI的平衡分解率αM = αN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴加到HA溶液中,测得混合溶液的pH与p![]() 转化关系如图所示[已知:p
转化关系如图所示[已知:p![]() =-lg
=-lg![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )
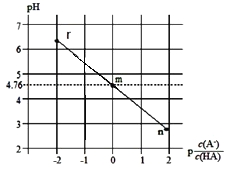
A.m点:c(A-)=c(HA)
B.Ka(HA)的数量级为10-6
C.水的电离程度:m<r
D.r点:c(H+)+c(Na+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:
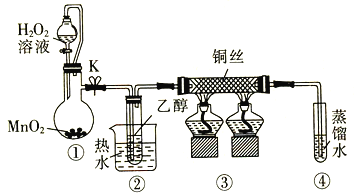
下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH和体积均相同的HNO2和CH3COOH溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是

A.电离平衡常数:Ka(CH3COOH)>Ka(HNO2)
B.溶液中水的电离程度:b>c
C.a点时,相同体积的两溶液分别与NaOH恰好中和后,溶液中的n(Na+)相等
D.从c点到d点,溶液中  的值保持小变
的值保持小变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杯环芳烃因其结构类似于酒杯而得名,其键线式如图,下列关于杯环芳烃的说法正确的是( )

A.属于芳香烃B.最多与6mol H2发生加成反应
C.分子式为C44H56O4D.分子内所有原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4 ①
R-OH+HBr![]() R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答:
(1)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是___(填字母)。
a.分液 b.蒸馏 c.萃取 d.过滤
(2)溴乙烷的水溶性___乙醇(填“大于”、“等于”或“小于”),其原因是___。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在___(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是___(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)为了检验溴乙烷中含有溴元素,通常采用的方法是:取少量溴乙烷,然后进行下列操作:①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液。下列操作顺序合理的是___(填字母)。
a.①②③④ b.②③①④ c.④①③② d. ①④②③
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3,工艺流程图如下:

(1)过程 I 中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是_______。
A 工业制硫酸 B 漂白纸张 C 自来水消毒
(2)过程II中发生的反应_______氧化还原反应(填“是”或“不是”)。
(3)过程V中操作为_______(填实验基本操作名称)。
(4)①检验Na3AsO3溶液中是否含有Fe3+的实验操作_______。
②过程IV中生成As2O3的离子反应方程式为_______。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为_______。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液100mL。
b.分别移取25.00mL上述溶液,用0.02500mol·L1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2 标准溶液液面读数如图二~图四所示。

①描述滴定终点的现象_______。
②粗产品中As2O3的质量分数为_______(用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是
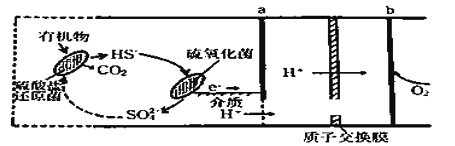
A. HS-在硫氧化菌作用下转化为SO42-的反应为:HS-+4H2O-8e-== SO42-+9H+
B. 电子从b流出,经外电路流向a
C. 如果将反应物直接燃烧,能量的利用率不会变化
D. 若该电池电路中有0.4mol电子发生转移,则有0.45molH+通过质子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com