
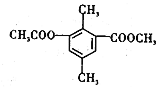
| A. | 分子中不同化学环境的氢共有4种 | |
| B. | 分子中所有的碳原子不可能共平面 | |
| C. | lmol该有机物与足量NaOH溶液反应,最多消耗3mol NaOH | |
| D. | 能发生取代、消去、加成和氧化反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| A | 检验淀粉水解产物有还原性 | 淀粉溶液和稀H2SO4混合加热,冷却后,再加新制的Cu(OH)2悬浊液加热至沸腾 |
| B | 证明SO2具有漂白性 | 将SO2通入溴水中 |
| C | 为了提取溴水中的溴 | 加入植物油进行萃取 |
| D | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与紫色石蕊溶液--先变红后褪色 | |
| B. | 过量的Cl2与KI淀粉溶液--变蓝 | |
| C. | SO2与紫色石蕊溶液--变红 | |
| D. | 硫化氢与湿润的醋酸铅试纸--变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
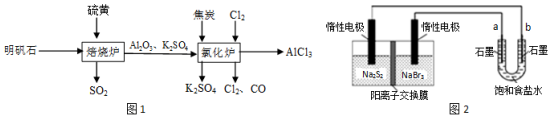
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 氯化铁溶液 | 氯化亚铁 | 过量铁粉 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和NaHCO3溶液 | 洗气 |
| C | 二氧化硅 | 氧化铝 | 氨水 | 过滤 |
| D | 氯化钠溶液 | 碘化钠 | 四氯化碳 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com