
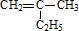 的键线式
的键线式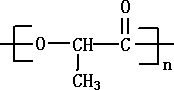 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为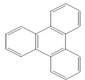 的一氯取代物有
的一氯取代物有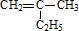 ,得到其键线式
,得到其键线式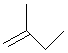 ,选最长的碳连做主链,CH3CH(C2H5)CH(C2H5)CH(CH3)2名称为:2,4-二甲基-3-乙基己烷,
,选最长的碳连做主链,CH3CH(C2H5)CH(C2H5)CH(CH3)2名称为:2,4-二甲基-3-乙基己烷, ;2,4-二甲基-3-乙基己烷;
;2,4-二甲基-3-乙基己烷; 可知,连接主链中含有酯基,为酯化反应进行的缩聚反应生成高聚物,故该单体的结构简式为:
可知,连接主链中含有酯基,为酯化反应进行的缩聚反应生成高聚物,故该单体的结构简式为: ,
, ;
; 中有2种等效氢原子,所以
中有2种等效氢原子,所以 的一氯取代物有2种,故答案为:2;
的一氯取代物有2种,故答案为:2;

 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
| A、多食用海产品可防治缺铁性贫血 |
| B、食物可调节人体细胞中的酸碱平衡 |
| C、为了减肥,我每天只吃水果、蔬菜 |
| D、我国应该禁止使用食物防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,读取滴定管末读数时,仰视刻度线 |
| B、测定硫酸铜晶体中结晶水含量的实验时,加热时间过短未完全变白 |
| C、中和滴定时,加待测液前锥形瓶内有少量水 |
| D、测定1mol氢气体积的操作中,反应结束后未抽气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
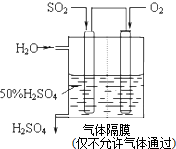
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
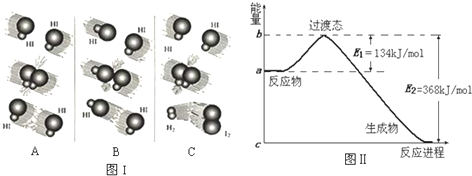
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量食盐 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com