
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A. 原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2
B. V1:V2=1:5
C. M点时生成的CO2为0.05mol
D. a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓
【答案】D
【解析】试题分析:Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸,首先发生反应AlO2-+H++H2O=Al(OH)3↓,a线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol。第二阶段,AlO2-反应完毕,发生反应CO32-+H+=HCO3-,b线表示CO32-,c线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol。第三阶段,CO32-反应完毕,发生反应HCO3-+H+=CO2↑+H2O,d线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+)。第四阶段,发生反应Al(OH)3+3H+=Al3++3H2O,e线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为![]() =0.15L=150mL。A、由上述分析可知,原混合溶液中的CO32-与AlO-2的物质的量之比为0.05mol:0.05mol=1:1,A错误;B、原溶液中n(CO32-)=0.05mol,V1时溶液中碳酸氢根离子等于碳酸根离子为0.025ml,由反应CO32-+H+=HCO3-可知,需要盐酸为0.025mol,盐酸的体积为
=0.15L=150mL。A、由上述分析可知,原混合溶液中的CO32-与AlO-2的物质的量之比为0.05mol:0.05mol=1:1,A错误;B、原溶液中n(CO32-)=0.05mol,V1时溶液中碳酸氢根离子等于碳酸根离子为0.025ml,由反应CO32-+H+=HCO3-可知,需要盐酸为0.025mol,盐酸的体积为![]() =0.025L=25mL,故V1=50mL+25mL=75mL,由上述分析可知,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,B错误;C、由上述分析可知M点时溶液中CO32-完全转化为HCO3-,没有CO2生成,C错误;D、由上述分析可知,a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓,D正确;答案选D。
=0.025L=25mL,故V1=50mL+25mL=75mL,由上述分析可知,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,B错误;C、由上述分析可知M点时溶液中CO32-完全转化为HCO3-,没有CO2生成,C错误;D、由上述分析可知,a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓,D正确;答案选D。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】25℃时,在一定体积pH = 12的NaOH溶液中, 加入一定体积0.01 mol/L的NaHSO4溶液,此时混合溶液的pH = 11。若反应后溶液的体积等于NaOH 溶液与NaHSO4溶液的体积之和,则NaOH溶液与NaHSO4溶液的体积比是( )
A. 1∶9 B. 10∶1 C. 11∶9 D. 1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2C12)常用于制造医药品、染料等。通常情况下其熔点为-54.1℃,沸点69.2℃,遇水发生剧烈反应生成氯化氢气体。某实验小组拟用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯,其实验装置如下:

(1)有关冷凝管的使用原理,下列说法正确的是(填字母)______________。
a.蒸气冷凝在内管的外壁上
b.当蒸馏液体的沸点超过140℃,水冷易炸裂仪器,此时多采用空气冷凝管
c.蛇形冷凝管多用于有机制备的回流,适用于沸点较低的液体
d.内外管所围出的空间为行水区,有吸收蒸气热量并将热量移走的功用
(2)B中的试剂为___________,作用为______________________________。
(3)在不改变装置的前提下,丁中的KClO3可用_____________代替(填化学式)。
(4)该小组向Cu(NO3)2·3H2O晶体中滴加SO2C12制备少量无水Cu(NO3)2。
①请写出SO2C12与水反应的化学方程式__________________________________。
②滴加SO2C12的作用除了吸水之外,还有_____________________________。
(5)测定无水Cu(NO3)2的纯度,可用分光光度法。现测得[Cu(NH3)4]2+的吸光度A与Cu2+标准浓度关系如图所示(已知4NH3·H2O+Cu2+==[Cu(NH3)4]2++4H2O)。
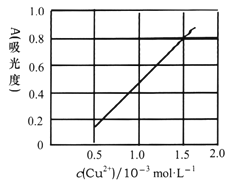
称取0.3150g制得的无水Cu(NO3)2样品,用蒸馏水溶解并配制成100mL溶液,用__________(填仪器名称)准确量取10.00mL,加过量氨水,再用蒸馏水稀释至100mL,测得其吸光度A=0.8。则此无水Cu(NO3)2样品的纯度是___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是___________。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
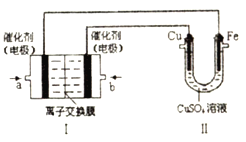
如图,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式是___________。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为___________。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH=___________(假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 含有金属元素的离子—定是阳离子
B. 含有离子键和共价键的化合物一定是离子化合物
C. 目前使用的元素周期表中,最长的周期含有36种元素
D. 第ⅦA族元素的阴离子还原性越强,其最高价氧化物的水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号和电子排布式:
X____________________ Y___________________
Z____________________ W___________________
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为________________。E在催化剂存在的条件下可用于还原汽车尾气中的______,以减少对大气的污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1的盐酸和醋酸,下列说法正确的是
A. 两种溶液的pH:盐酸大于醋酸
B. 用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多
C. 向醋酸中加入等物质的量的NaOH,溶液呈碱性,且溶液中![]()
D. 两种溶液中水电离出的氢离子:盐酸大于醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A. 反应需在300 ℃进行可推测该反应是吸热反应
B. 使用催化剂可提高反应速率
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com